题目内容
某元素最高价氧化物的水化物的化学式为 HxROy,且为强酸.气态氢化物的化学式为HxR,已知 1mol的HxROy 比 1mol 的HxR 质量多 64g,又知道1mol的HxROy 的原子核外电子总数为50mol.求R的原子序数为
16
16
或17
17
.分析:根据分子式特点确定出多的质量为氧原子的质量,进而计算y值,再根据HxROy 的原子核外电子总数为50个,确定气态氢化物HxR一个分子含有的电子数,据此解答.
解答:解:由分子式看出HxROy比 HxR 多y个O原子,
1摩尔的HxROy比1摩尔的HxR质量多64克,多的质量为ymol氧原子的质量,
所以:16g/mol×y mol=64g,
可得y=4,
所以HxROy 分子式为HxRO4,
又1mol的HxROy 的原子核外电子总数为50mol,
所以一个HxR分子含有的电子数为50-8×4=18,
HxRO4为强酸,所以HxR为H2S或HCl,即R元素为硫元素或氯元素,原子序数为16或17,
故答案为:16;17.
1摩尔的HxROy比1摩尔的HxR质量多64克,多的质量为ymol氧原子的质量,
所以:16g/mol×y mol=64g,
可得y=4,
所以HxROy 分子式为HxRO4,
又1mol的HxROy 的原子核外电子总数为50mol,
所以一个HxR分子含有的电子数为50-8×4=18,
HxRO4为强酸,所以HxR为H2S或HCl,即R元素为硫元素或氯元素,原子序数为16或17,
故答案为:16;17.
点评:本题考查原子序数的确定,关键在于分析分子式,得出多的质量为氧原子的质量,并熟悉电子数的计算方法即可解答.

练习册系列答案
 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案
相关题目

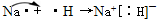


 ,质量数A是137,中子数N
,质量数A是137,中子数N