题目内容
判断存放的FeCl2溶液是否变质.从现象观察看 ;鉴定的方法为加入 试剂,若溶液出现 ;则证明有 存在.实验室为了防止FeCl2溶液变质,在配制时常加入 .向FeSO4溶液中滴加NaOH溶液,并放置一段时间,此过程中观察到的现象 .
考点:二价Fe离子和三价Fe离子的检验,铁盐和亚铁盐的相互转变
专题:几种重要的金属及其化合物
分析:在溶液中亚铁离子为浅绿色,铁离子为黄色,根据颜色变化分析;检验三价铁离子遇到KSCN会变血红色;配制FeCl2溶液要防止其水解和被氧化;氢氧化亚铁在空气中易被氧化.
解答:
解:在溶液中亚铁离子为浅绿色,铁离子为黄色,从现象观察若溶液颜色变为黄色,则存放的FeCl2溶液因氧化而变质;加入KSCN溶液试剂,若溶液出现血红色;则证明有Fe3+ 存在;配制FeCl2溶液要防止其水解,需要加盐酸抑制其水解,为了防止亚铁离子被氧化,需要加铁粉;硫酸亚铁和氢氧化钠发生反应生成氢氧化亚铁白色沉淀,该白色沉淀易被氧化为氢氧化铁,则向FeSO4溶液中滴加NaOH溶液,并放置一段时间,此过程中观察到的现象:白色沉淀生成,且白色沉淀迅速变成灰绿色,最后变成红褐色;
故答案为:溶液是否变为黄色;KSCN;血红色;Fe3+;铁粉和盐酸;白色沉淀生成,且白色沉淀迅速变成灰绿色,最后变成红褐色.
故答案为:溶液是否变为黄色;KSCN;血红色;Fe3+;铁粉和盐酸;白色沉淀生成,且白色沉淀迅速变成灰绿色,最后变成红褐色.
点评:本题考查了亚铁离子和铁离子的检验、及亚铁离子和铁离子的转化,题目难度不大,侧重于基础知识的考查,注意把握Fe及其化合物的性质.

练习册系列答案
相关题目
有一种脂肪醇,通过一系列反应可变为丙三醇,这种脂肪醇通过消去、氧化、酯化、加聚反应等变化后可转化为一种高聚物  ,这种醇的结构简式可能为( )
,这种醇的结构简式可能为( )
 ,这种醇的结构简式可能为( )
,这种醇的结构简式可能为( )| A、CH2=CHCH2OH |
| B、CH2ClCHClCH2OH |
| C、CH3CH2OH |
| D、CH3CH(OH)CH2OH |
海洋是个巨大的资源宝库,蕴含的元素有80多种,从海水中可以提取食盐、溴、镁、碘等多种物质.地球上99%以上的元素X蕴藏在大海中,海水中总储量高达1×1014t,因此被称作“海洋元素”.“海洋元素”X是( )
| A、Na | B、Cl | C、Br | D、Mg |
下列有关金属冶炼的说法中,不正确的是( )
| A、用电解熔融氯化钠的方法得到活泼金属钠 |
| B、在加热的情况下利用氢气还原三氧化二铝得到金属铝 |
| C、用铝热反应原理炼得熔点较高的金属铬 |
| D、热分解法直接加热HgO得到金属Hg |
微粒甲与离子乙在溶液中的转化关系如图所示:微粒甲
离子乙
微粒,微粒甲不可能是( )
| OH- |
| H+ |
| A、CO2 |
| B、NH4+ |
| C、Al3+ |
| D、Fe2O3 |
 实验室制乙酸乙脂的装置如图:
实验室制乙酸乙脂的装置如图: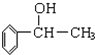 所示:
所示: