题目内容
元素周期表中第四周期的金属元素在生产和科研中有非常重要的使用价值.
(1)测定土壤中铁的含量时需先将三价铁还原为二价铁,再采用邻啡罗啉作显色剂,用比色法
测定,若土壤中含有高氯酸盐时会对测定有干扰.相关的反应如下:
4FeCl3+2NH2OH?HCl=4FeCl2+N2O↑+6HCl+H2O
①Fe3+在基态时,核外电子排布式 ;
②羟胺中(NH2OH)采用sp3杂化的原子有 ,三种元素电负性由大到小的顺序为 ;
③Fe2+与邻啡罗啉(用A表示)形成的配合物[FeA3]2+(图1)中,Fe2+的配位数为 ;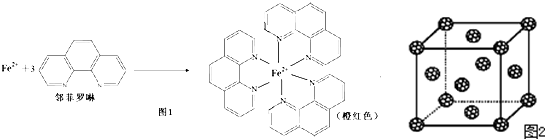
④N2O分子的空间构型为 ;(用文字描述)
(2)如果把晶胞顶点与最近三个面心所围成的空隙叫做四面体空隙,第四周期电负性最小的原子可作为容体掺入C60 晶体的空隙中,形成具有良好的超导性的掺杂C60 化合物.现把C60抽象成质点,该晶体的晶胞结构如图2所示,若每个四面体空隙填入一个原子,则全部填满C60 晶体的四面体空隙后,所形成的掺杂C60 化合物的化学式为 .
(1)测定土壤中铁的含量时需先将三价铁还原为二价铁,再采用邻啡罗啉作显色剂,用比色法
测定,若土壤中含有高氯酸盐时会对测定有干扰.相关的反应如下:
4FeCl3+2NH2OH?HCl=4FeCl2+N2O↑+6HCl+H2O
①Fe3+在基态时,核外电子排布式
②羟胺中(NH2OH)采用sp3杂化的原子有
③Fe2+与邻啡罗啉(用A表示)形成的配合物[FeA3]2+(图1)中,Fe2+的配位数为

④N2O分子的空间构型为
(2)如果把晶胞顶点与最近三个面心所围成的空隙叫做四面体空隙,第四周期电负性最小的原子可作为容体掺入C60 晶体的空隙中,形成具有良好的超导性的掺杂C60 化合物.现把C60抽象成质点,该晶体的晶胞结构如图2所示,若每个四面体空隙填入一个原子,则全部填满C60 晶体的四面体空隙后,所形成的掺杂C60 化合物的化学式为
考点:晶胞的计算,判断简单分子或离子的构型,配合物的成键情况
专题:
分析:(1)①铁是26号元素,铁原子核外有26个电子,铁原子失去3个电子变成铁离子,根据构造原理写出铁离子核外电子排布式;
②根据价层电子对互斥理论确定羟胺NH2OH中存在sp3杂化的原子;同一周期元素电负性从左到右递增;
③配位数就是在配位个体中与一个形成体成键的配位原子的总数;
④N2O与CO2是等电子体,具有相似的结构;
(2)三个球相切,摆成正三角形,然后上面放第四个球,这样围成的空隙,就叫正四面体空隙,在面心立方结构中,每个小立方体对应1个四面体空隙,一共有8个正四面体空隙,上图画出了其中一个,第四周期电负性最小的原子是K,所以晶胞中一共有8个k原子,1+6×
=4个C60分子,然后求出化学式.
②根据价层电子对互斥理论确定羟胺NH2OH中存在sp3杂化的原子;同一周期元素电负性从左到右递增;
③配位数就是在配位个体中与一个形成体成键的配位原子的总数;
④N2O与CO2是等电子体,具有相似的结构;
(2)三个球相切,摆成正三角形,然后上面放第四个球,这样围成的空隙,就叫正四面体空隙,在面心立方结构中,每个小立方体对应1个四面体空隙,一共有8个正四面体空隙,上图画出了其中一个,第四周期电负性最小的原子是K,所以晶胞中一共有8个k原子,1+6×
| 1 |
| 2 |
解答:
解:(1)①铁是26号元素,铁原子核外有26个电子,铁原子失去2个电子变成亚铁离子,Fe3+在基态时,核外电子排布式为ls22s22p63s23p63d5或[Ar]3d5;
故答案为:ls22s22p63s23p63d5或[Ar]3d5;
②羟胺分子中,价层电子对为4的原子有N、O原子,所以采用sp3杂化的原子有N、O原子,同一周期元素电负性从左到右递增,在NH2OH中,H显正价,H的电负性最小,故电负性大小顺序是O>N>H;
故答案为:N、O;O>N>H;
③配位数就是在配位个体中与一个形成体成键的配位原子的总数,所以Fe2+与邻啡罗啉形成的配合物(形成过程如图1)中,配位数为6,故答案为:6;
④N2O与CO2是等电子体,具有相似的结构,应为直线形分子,故答案为:直线型;
(2)三个球相切,摆成正三角形,然后上面放第四个球,这样围成的空隙,就叫正四面体空隙,如图所示: 在面心立方结构中,每个小立方体对应1个四面体空隙,一共有8个正四面体空隙,上图画出了其中一个,第四周期电负性最小的原子是K,所以晶胞中一共有8个K原子,1+6×
在面心立方结构中,每个小立方体对应1个四面体空隙,一共有8个正四面体空隙,上图画出了其中一个,第四周期电负性最小的原子是K,所以晶胞中一共有8个K原子,1+6×
=4个C60分子,故组成 K8(C60)4,化学式为K2C60.
故答案为:K2C60.
故答案为:ls22s22p63s23p63d5或[Ar]3d5;
②羟胺分子中,价层电子对为4的原子有N、O原子,所以采用sp3杂化的原子有N、O原子,同一周期元素电负性从左到右递增,在NH2OH中,H显正价,H的电负性最小,故电负性大小顺序是O>N>H;
故答案为:N、O;O>N>H;
③配位数就是在配位个体中与一个形成体成键的配位原子的总数,所以Fe2+与邻啡罗啉形成的配合物(形成过程如图1)中,配位数为6,故答案为:6;
④N2O与CO2是等电子体,具有相似的结构,应为直线形分子,故答案为:直线型;
(2)三个球相切,摆成正三角形,然后上面放第四个球,这样围成的空隙,就叫正四面体空隙,如图所示:
 在面心立方结构中,每个小立方体对应1个四面体空隙,一共有8个正四面体空隙,上图画出了其中一个,第四周期电负性最小的原子是K,所以晶胞中一共有8个K原子,1+6×
在面心立方结构中,每个小立方体对应1个四面体空隙,一共有8个正四面体空隙,上图画出了其中一个,第四周期电负性最小的原子是K,所以晶胞中一共有8个K原子,1+6×| 1 |
| 2 |
故答案为:K2C60.
点评:本题目综合性较大,涉及晶体、化学键、杂化轨道、电负性、晶胞计算等,晶胞计算难度较大,为易错点.

练习册系列答案
相关题目
下列有关NaCl在生物技术实践中的应用,正确的是( )
| A、在配制牛肉膏蛋白胨固体培养基时,需加入琼脂,不需要添加NaCl |
| B、利用DNA在不同浓度的NaCl溶液中的溶解度不同,粗提取DNA |
| C、在腐乳制作过程中,装瓶时需逐层等量加入NaCl,以防杂菌污染 |
| D、将哺乳动物的成熟红细胞浸泡于0.9%的NaCl溶液中,用以制备纯净的细胞膜 |
下列关于煤的干馏的叙述中,正确的是( )
| A、煤加强热而分解的过程叫做煤的干馏 |
| B、煤干馏的目的是得到冶金用的优质焦炭 |
| C、煤的干馏和石油的分馏的本质差别是:干馏是物理变化,而分馏是化学变化 |
| D、工业上苯等芳香烃原料可由煤干馏得到,其存在于干馏所得的焦炉气中 |
室温下,某溶液中由水电离的c(H+)=10-13mol/L,下列各离子组在该溶液中一定不能大量共存的是( )
| A、NH4+、Cu2+、Cl-、NO3- |
| B、K+、Na+、SO32-、S2- |
| C、Ba2+、Fe2+、NO3-、Br- |
| D、K+、Na+、SO42-、AlO2- |
人们日益重视环境问题,下列说法不正确的是( )
| A、人类超量碳排放及氮氧化物和二氧化硫的排放是形成酸雨的主要原因 |
| B、装饰装修材料中的甲醛、芳香烃及放射性物质都会造成室内污染 |
| C、煤燃烧时加入少量的石灰石可以减少废气中的二氧化硫排放 |
| D、我国自实施“限塑令”以来,“白色污染”在一定程度上得到有效遏制 |


