题目内容
 化学反应的快慢和限度对人类生产生活有重要的意义.
化学反应的快慢和限度对人类生产生活有重要的意义.(1)将影响反应速率条件填在空格处.
| 实 例 | 影响条件 |
| ①食物放在冰箱里能延长保质期 | |
| ②实验室将块状药品研细,再进行反应 | |
| ③用H2O2分解制O2时,加入MnO2 | |
| ④实验室制备H2时,用较浓的硫酸与Zn粒反应 |
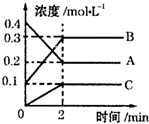
①该反应生成物是
②2min内,用C表示的反应速率为
③该反应的方程式为
④在其他条件下,测得A的反应速率为0.05mol/(L?s),此时的反应与800℃时相比,
A.比800℃时快 B.比800℃时慢 C.和800℃时速率一样.
考点:化学反应速率的影响因素,物质的量或浓度随时间的变化曲线
专题:化学平衡专题,化学反应速率专题
分析:(1)影响化学反应速率的因素有温度、浓度、催化剂以及固体的表面积大小等,从实验的目的考虑选择的措施;
(2)由图象可知,A的物质的量浓度减小,B和C的物质的量浓度增加,则A为反应物,B和C为生成物,由反应的浓度的变化之比等于化学计量数之比可得:△c(A):△c(B):△c(C)=0.2mol/L:0.2mol/L:0.1mol/L=2:2:1,则反应的化学方程式为2A 2B+C,根据v=
2B+C,根据v=
计算反应速率.
(2)由图象可知,A的物质的量浓度减小,B和C的物质的量浓度增加,则A为反应物,B和C为生成物,由反应的浓度的变化之比等于化学计量数之比可得:△c(A):△c(B):△c(C)=0.2mol/L:0.2mol/L:0.1mol/L=2:2:1,则反应的化学方程式为2A
 2B+C,根据v=
2B+C,根据v=| △c |
| △t |
解答:
解:(1)①冰箱内温度较低,降低温度,反应速率减小,可延长保质期,故答案为:温度;
②固体表面积的大小影响化学反应速率,表面积越大,反应速率越快,实验室将块状药品研细,可加快反应速率,故答案为:固体表面积;
③催化剂能加快反应速率,用H2O2分解制O2时,加入MnO2,起到催化剂的作用,能较快生成气体,故答案为:催化剂;
④对于溶液中的化学反应,增大反应物浓度能加快反应速率,用较浓的硫酸与Zn粒反应,增大生成氢气的速率,但浓度不能过大,如是浓硫酸则不能生成氢气,故答案为:浓度;
(2)①由图象可知,A的物质的量浓度减小,B和C的物质的量浓度增加,则A为反应物,B和C为生成物,故答案为:B和C;
②v=
=
=0.05mol/(L?min),故答案为:0.05mol/(L?min);
③由反应的浓度的变化之比等于化学计量数之比可得:△c(A):△c(B):△c(C)=0.2mol/L:0.2mol/L:0.1mol/L=2:2:1,则反应的化学方程式为2A 2B+C,故答案为:2A?2B+C;
2B+C,故答案为:2A?2B+C;
④当A的反应速率为0.05mol/(L?s),则用C表示的速率为:v(C)=0.025mol/(L?min),根据②的结果,v(C)=0.05mol/(L?min),此时的反应与800℃时相比800℃时慢,故答案为:B.
②固体表面积的大小影响化学反应速率,表面积越大,反应速率越快,实验室将块状药品研细,可加快反应速率,故答案为:固体表面积;
③催化剂能加快反应速率,用H2O2分解制O2时,加入MnO2,起到催化剂的作用,能较快生成气体,故答案为:催化剂;
④对于溶液中的化学反应,增大反应物浓度能加快反应速率,用较浓的硫酸与Zn粒反应,增大生成氢气的速率,但浓度不能过大,如是浓硫酸则不能生成氢气,故答案为:浓度;
(2)①由图象可知,A的物质的量浓度减小,B和C的物质的量浓度增加,则A为反应物,B和C为生成物,故答案为:B和C;
②v=
| △c |
| t |
| 0.1mol/L |
| 2min |
③由反应的浓度的变化之比等于化学计量数之比可得:△c(A):△c(B):△c(C)=0.2mol/L:0.2mol/L:0.1mol/L=2:2:1,则反应的化学方程式为2A
 2B+C,故答案为:2A?2B+C;
2B+C,故答案为:2A?2B+C;④当A的反应速率为0.05mol/(L?s),则用C表示的速率为:v(C)=0.025mol/(L?min),根据②的结果,v(C)=0.05mol/(L?min),此时的反应与800℃时相比800℃时慢,故答案为:B.
点评:本题考查化学反应速率的影响因素及应用,题目难度不大,注意基础知识的积累.

练习册系列答案
相关题目
水体污染物有:I含盐酸的酸性废水,II悬浮颗粒,III重金属离子;污水处理的化学方法有:a中和法,b沉淀法,c混凝法.所采用的方法对水体污染物处理不正确的是( )
| A、I-a | B、I-b |
| C、II-c | D、III-b |


