题目内容
铁是应用最广泛的金属,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物.
(1)要确定铁的某氯化物FeClx的化学式,可用离子交换和滴定的方法.实验中称取0.54g的FeClx样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH-的阴离子交换柱,使Cl-和OH-发生交换.交换完成后,流出溶液的OH-用0.40mol/L的盐酸滴定,滴至终点时消耗盐酸25.0mL.计算该样品中氯的物质的量,并求出FeClx中,x值为 ;
(2)现有一含有FeCl2和FeCl3的混合物样品,采用上述方法测得n(Fe):n(C1)=1:2.1,则该样品中FeCl3的物质的量分数为 ;
(3)FeCl3与氢碘酸反应时可生成棕色物质,该反应的离子方程式为 ;
(4)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料.FeCl3与KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为 .
(1)要确定铁的某氯化物FeClx的化学式,可用离子交换和滴定的方法.实验中称取0.54g的FeClx样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH-的阴离子交换柱,使Cl-和OH-发生交换.交换完成后,流出溶液的OH-用0.40mol/L的盐酸滴定,滴至终点时消耗盐酸25.0mL.计算该样品中氯的物质的量,并求出FeClx中,x值为
(2)现有一含有FeCl2和FeCl3的混合物样品,采用上述方法测得n(Fe):n(C1)=1:2.1,则该样品中FeCl3的物质的量分数为
(3)FeCl3与氢碘酸反应时可生成棕色物质,该反应的离子方程式为
(4)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料.FeCl3与KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为
考点:复杂化学式的确定,化学方程式的有关计算
专题:计算题
分析:(1)依据0.54g FeClx中氯离子物质的量计算x值;
(2)依据元素守恒计算氯化亚铁和氯化铁物质的量之比,进一步计算氯化铁质量分数;氯化亚铁用铁和稀酸反应生成,氯化铁可以直接用铁和氯气反应得到;
(3)氧化铁与氢碘酸发生氧化还原反应生成碘化亚铁、碘、水;
(4)用FeCl3与KClO在强碱性条件下反应制取K2FeO4,反应的离子方程式为2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O.
(2)依据元素守恒计算氯化亚铁和氯化铁物质的量之比,进一步计算氯化铁质量分数;氯化亚铁用铁和稀酸反应生成,氯化铁可以直接用铁和氯气反应得到;
(3)氧化铁与氢碘酸发生氧化还原反应生成碘化亚铁、碘、水;
(4)用FeCl3与KClO在强碱性条件下反应制取K2FeO4,反应的离子方程式为2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O.
解答:
解:(1)n(Cl)=n(H+)=n(OH-)=0.0250L×0.40 mol?L-1=0.010 mol,0.54g FeClx样品中含有氯离子物质的量为
=0.010 mol,解得x=3,
故答案为:3;
(2)FeCl2和FeCl3的混合物的样品中FeCl2物质的量为x,FeCl3的物质的量为y,则(x+y):(2x+3y)=1:2.1,得到x:y=9:1,氯化铁物质的量分数=
×100%=10%;
故答案为:10%;
(3)三价铁具有氧化性,碘化氢具有还原性,发生氧化还原反应生成碘化亚铁、碘、水,发生的离子反应为Fe2O3+6H++2I-=2Fe2++I2+3H2O,
故答案为:Fe2O3+6H++2I-=2Fe2++I2+3H2O;
(4)次氯酸钾中吕伟+1价具有强氧化性,可将+3价的铁氧化成+6价,用FeCl3与KClO在强碱性条件下反应制取K2FeO4,反应的离子方程式为:2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O,
故答案为:2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O.
| 0.54g |
| 56+35.5x |
故答案为:3;
(2)FeCl2和FeCl3的混合物的样品中FeCl2物质的量为x,FeCl3的物质的量为y,则(x+y):(2x+3y)=1:2.1,得到x:y=9:1,氯化铁物质的量分数=
| 1 |
| 1+9 |
故答案为:10%;
(3)三价铁具有氧化性,碘化氢具有还原性,发生氧化还原反应生成碘化亚铁、碘、水,发生的离子反应为Fe2O3+6H++2I-=2Fe2++I2+3H2O,
故答案为:Fe2O3+6H++2I-=2Fe2++I2+3H2O;
(4)次氯酸钾中吕伟+1价具有强氧化性,可将+3价的铁氧化成+6价,用FeCl3与KClO在强碱性条件下反应制取K2FeO4,反应的离子方程式为:2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O,
故答案为:2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O.
点评:本题考查学生阅读题目获取信息的能力、氧化还原反应、方程式书写,混合物质量分数计算,难度中等,要求学生要有扎实的基础知识和灵活运用知识解决问题的能力.注意基础知识的全面掌握.

练习册系列答案
相关题目
日常生活中人们常喝纯净水,市场上出售的纯净水有一些是蒸馏水,对于这一类纯净水的下列说法,正确的是( )
| A、它能够导电 |
| B、它的pH=0 |
| C、它含有人体所需的矿物质和多种微量元素 |
| D、它清洁、纯净,但长期饮用对人健康无益 |
一系列物质:NaCl、Cl2、NaClO、Cl2O5、HClO4是按某一规律排列的,下列组合中也完全照此规律排列的是( )
| A、Na2CO3 C CO2 CO NaHCO3 |
| B、Na2S S SO2 Na2SO3 Na2SO4 |
| C、NH4Cl N2 NaNO2 NO2 HNO3 |
| D、P2O5 H3PO4 Na3PO4 Na2HPO4 NaH2PO4 |
实验室需要使AlCl3溶液中的Al3+离子全部沉淀出来,适宜的试剂是( )
| A、NaOH溶液 |
| B、氨水 |
| C、盐酸 |
| D、Ba(OH)2溶液 |
下列有关铝化合物说法正确的是( )
| A、氧化铝的熔点很高,所以不可以用来冶炼铝 |
| B、氢氧化铝可以和悬浮于水中的泥沙形成絮状不溶物沉降下来,使水澄清,所以明矾可用作净水剂 |
| C、实验室可以用过量氢氧化钠与氯化铝来制备氢氧化铝 |
| D、氢氧化铝既可与酸反应又可与碱反应,是两性氢氧化物 |
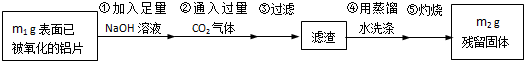
 分别称取质量为m1g的NaHCO3和NaOH的固体混合物样品两份,置于密闭容器中,在300℃条件下充分加热,排尽气体后,测得剩余固体质量为 m2g.小林和小芳两同学对加热后的剩余固体进行研究.为研究方便,令
分别称取质量为m1g的NaHCO3和NaOH的固体混合物样品两份,置于密闭容器中,在300℃条件下充分加热,排尽气体后,测得剩余固体质量为 m2g.小林和小芳两同学对加热后的剩余固体进行研究.为研究方便,令