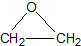
题目内容
将Cl2用导管通入较浓的NaOH和H2O2的混合液中,导管与混合液接触处有闪烁的红光出现.这是因为通气后混合液产生的ClO-被H2O2还原,剧烈的反应产生能量较高的氧分子,它立即转变为普通氧分子,多余的能量以红光形式放出.测得红光波长为λ=0.6000μm.用此红光做光电效应实验,已知光电效应实验中,阴极用极限频率为v0=6.000×1014Hz的钠制成.求:(1)写出有关离子方程式:________(2)请用计算回答,能否产生光电效应.________
答案:
解析:
解析:
|
(1)Cl2+2OH-=Cl-+ClO-+H2O ClO-+H2O2=Cl-+O2↑+H2O (2)入射光频率v= =5.00×1014Hz<6.00×1014Hz 所以不能产生光电效应 |

练习册系列答案
 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案
相关题目
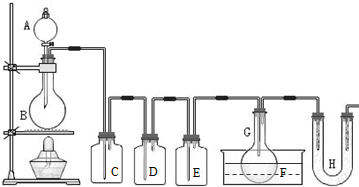 (2011?静安区模拟)用如图所示装置制取PCl3,在E中放入足量白磷,将氯气不间断地通入E,氯气与白磷就会发生反应,并放出热量(温度高于75℃).已知:PCl3和 PCl5遇水强烈反应,它们熔沸点数据如下:
(2011?静安区模拟)用如图所示装置制取PCl3,在E中放入足量白磷,将氯气不间断地通入E,氯气与白磷就会发生反应,并放出热量(温度高于75℃).已知:PCl3和 PCl5遇水强烈反应,它们熔沸点数据如下:
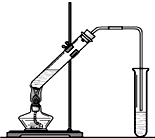 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题: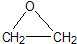 +CaCl2+H2O
+CaCl2+H2O