题目内容
3.下列说法正确的是( )| A. | 石油裂解、煤的气化、海水制镁等过程中都包含化学变化 | |
| B. | 可通过电解熔融MgCl2来制取金属镁,故也能通过电解熔融AlCl3来制取铝 | |
| C. | 铝热剂、盐酸、水玻璃、双氧水、明矾均为混合物 | |
| D. | Na2O2、NaOH、NH4Cl均为含共价键的离子化合物 |
分析 A.有新物质生成的变化属于化学变化,没有新物质生成的变化属于物理变化;
B.AlCl3的共价化合物,熔融状态下不导电;
C.混合物是两种或两种以上的物质组成,溶液肯定是混合物;
D.活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,离子化合物一定含有离子键,可能含有共价键.
解答 解:A.石油裂解获得乙烯、丙烯、丁二烯、丁烯、乙炔,生成了新物质;煤的气化生成了一氧化碳和氢气,生成了新物质;海水制镁由镁离子得到单质镁,生成了新物质;所以石油裂解、煤的气化、海水制镁等过程中都包含化学变化,故A正确;
B.工业上,电解熔融MgCl2冶炼金属镁;AlCl3的共价化合物,熔融状态下不导电,所以电解Al2O3与冰晶石熔融混合物的方法生产铝,故B错误;
C.铝热剂是铁和氧化铝的混合物、盐酸是氯化氢水溶液、水玻璃是硅酸钠水溶液、均为混合物,双氧水、明矾均为纯净物,故C错误;
D.Na2O2、NaOH、NH4Cl均为含共价键的离子化合物,故D正确;
故选AD.
点评 本题主要考查了物质的变化、电解法冶炼金属、物质的分类与物质的结构,难度不大,注意知识的掌握.

练习册系列答案
 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案
相关题目
11.下列有关有机物的物理性质或用途描述正确的是( )
| A. | 七氟丙烷可以用来做灭火剂 | |
| B. | 正戊烷、异戊烷和新戊烷的沸点依次升高 | |
| C. | 苯酚与水形成的浊液静置后分层,下层是溶有苯酚的水层 | |
| D. | 常温下卤代烃均为气态 |
18.在锌与某浓度的盐酸反应的实验中,实验员得到下面的结果:
(1)写出实验中发生反应的离子方程式:Zn+2H+=Zn2++H2↑,
(2)仔细观察A~F的实验数据对比,你可以得到关于温度影响反应速率结论,用此结论,计算:55℃时,2g 锌薄片溶解于酸中需花12.5 s.
(3)对比结果B与F,解释结果F那么快的原因:B中锌是块状,F中锌是粉末状,粉末状时锌与酸溶液的接触面要 比块状时的接触面大得多.
| 锌的质量(g) | 锌的形状 | 温度(℃) | 溶解于酸花的时间(s) | |
| A | 2 | 薄片 | 5 | 400 |
| B | 2 | 薄片 | 15 | 200 |
| C | 2 | 薄片 | 25 | 100 |
| D | 2 | 薄片 | 35 | 50 |
| E | 2 | 薄片 | 45 | 25 |
| F | 2 | 粉末 | 15 | 5 |
(2)仔细观察A~F的实验数据对比,你可以得到关于温度影响反应速率结论,用此结论,计算:55℃时,2g 锌薄片溶解于酸中需花12.5 s.
(3)对比结果B与F,解释结果F那么快的原因:B中锌是块状,F中锌是粉末状,粉末状时锌与酸溶液的接触面要 比块状时的接触面大得多.
8.下列系统命名法正确的是( )
| A. | 2-甲基-4-乙基戊烷 | B. | 2-甲基-3-丁炔 | ||
| C. | 2,3-二乙基-1-戊烯 | D. | 三溴苯酚 |


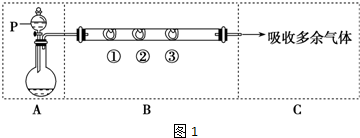
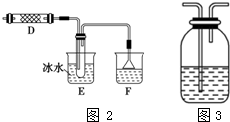
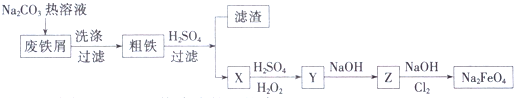
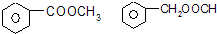 .
. 研究含Cl、N、S等元素的化合物对净化水质、防治污染有重要意义.
研究含Cl、N、S等元素的化合物对净化水质、防治污染有重要意义.