题目内容
(10分)盐酸、硫酸和硝酸都是重要的化工原料,也是化学实验室里必备的重要试剂。请回答下列问题:
(1)常温下,可用铁、铝制的容器盛放浓硫酸,说明浓硫酸具有 性。用玻璃棒蘸取浓硫酸滴在纸上,纸逐渐变黑,说明浓硫酸具有 性。
(2)硝酸铜是制备Cu-Zn-Al系催化剂的重要原料,工业上用洗净的废铜屑作原料来制备硝酸铜。下列制备方法符合“绿色化学”思想的是 (填序号)。
① Cu + HNO3(浓)→ Cu(NO3)2 ② Cu + HNO3(稀)→ Cu(NO3)2
③ Cu 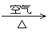 CuO
CuO
 Cu(NO3)2
Cu(NO3)2
(3)①在100mL 18mol·L-1的浓硫酸中加入过量的铜片,加热使之充分反应,测得产生的气体在标准状况下的体积可能是 。
A.40.32L B.30.24L C.20.16L D.13.44L
②若使上述反应①中剩余的铜片继续溶解,可向其中加入硝酸钠,写出反应的离子方程式 。
(4)某同学向浸泡铜片的稀盐酸中加入H2O2后,铜片溶解,并且该反应的产物只有氯化铜和水。该反应的化学方程式为 。
.(10分) (1)强氧化性 脱水性 (2分)
(2)③ (2分)
(3)① D ② 3Cu + 8H+ + 2NO3- === 3Cu2+ + 2NO↑+ 4H2O (4分)
(4) Cu + 2HCl + H2O2 === CuCl2 +2H2O (2分)
【解析】考查盐酸、硝酸和硫酸的性质及化学方程式的书写及有关计算。
(1)浓硫酸具有强氧化性,能使铁或铝在常温下发生钝化;同时浓硫酸还具有脱水性,可以使纸张炭化而变黑。
(2)反应①②中都会产生大气污染物NO或NO2,因此不符号绿色化学的思想。而反应③中不会产生大气污染物,因此符号绿色化学思想,答案选③。
(3)①浓硫酸的物质的量是0.1L×18mol/L=1.8mol,根据反应的方程式Cu+2H2SO4(浓) CuSO4+2H2O+SO2↑可知,由于随着反应的进行,硫酸的浓度会逐渐降低,因此实际产生的气体小于0.9mol,即体积小于0.9mol×22.4L/mol=20.16L,所以只有选项D正确,答案选D。
CuSO4+2H2O+SO2↑可知,由于随着反应的进行,硫酸的浓度会逐渐降低,因此实际产生的气体小于0.9mol,即体积小于0.9mol×22.4L/mol=20.16L,所以只有选项D正确,答案选D。
②在酸性条件下硝酸银具有氧化性,能氧化单质铜,反应的方程式是3Cu + 8H+ + 2NO3- === 3Cu2+ + 2NO↑+ 4H2O。
(4)双氧水具有氧化性,也能氧化单质铜,而双氧水的还原产物是水,反应的方程式是 Cu + 2HCl + H2O2 === CuCl2 +2H2O。

 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案(10分)盐酸、硫酸和硝酸都是重要的化工原料,也是化学实验室里必备的重要试剂。请回答下列问题:
(1)常温下,可用铁、铝制的容器盛放浓硫酸,说明浓硫酸具有 性。用玻璃棒蘸取浓硫酸滴在纸上,纸逐渐变黑,说明浓硫酸具有 性。
(2)硝酸铜是制备Cu-Zn-Al系催化剂的重要原料,工业上用洗净的废铜屑作原料来制备硝酸铜。下列制备方法符合“绿色化学”思想的是 (填序号)。
① Cu + HNO3(浓)→ Cu(NO3)2 ② Cu + HNO3(稀)→ Cu(NO3)2
③ Cu  CuO
CuO  Cu(NO3)2
Cu(NO3)2
(3)①在100mL 18mol·L-1的浓硫酸中加入过量的铜片,加热使之充分反应,测得产生的气体在标准状况下的体积可能是 。
| A.40.32L | B.30.24L | C.20.16L | D.13.44L |
(4)某同学向浸泡铜片的稀盐酸中加入H2O2后,铜片溶解,并且该反应的产物只有氯化铜和水。该反应的化学方程式为 。


 H2NCONHSO3H(s)
△H<0
H2NCONHSO3H(s)
△H<0 2H2NSO3H + CO2↑
2H2NSO3H + CO2↑



 产生常用湿润的淀粉—KI试纸。如果有Cl
产生常用湿润的淀粉—KI试纸。如果有Cl