题目内容
20.下列说法或表示方法正确的是( )| A. | 等物质的量的硫蒸气和硫粉分别完全燃烧,后者放出热量多 | |
| B. | 由C(石墨)→C(金刚石)△H=+119 kJ/mol可知,金刚石比石墨稳定 | |
| C. | 在25℃,1.01×105Pa时,2 g氢气完全燃烧生成液态水,放出285.8 kJ热量,则氢气燃烧的热化学方程式可表示为:2H2(g)+O2(g)=2H2O(l)△H=-571.6 kJ/mol | |
| D. | H+(aq)+OH-(aq)=H2O(l)△H=-57.3 kJ/mol,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的氢氧化钠溶液混合,放出的热量等于57.3 kJ |
分析 A.硫蒸气所含能量比硫固体高;
B.能量越低越稳定,石墨能量低稳定;
C.2g氢气是1mol,注意热化学方程式的化学计量数,反应热与计量数成正比;
D.根据中和热的概念分析,浓硫酸溶于水放热.
解答 解:A.硫蒸气所含能量比硫固体高,所以等物质的量的硫蒸汽和硫固体分别完全燃烧,前者放出热量多,故A错误;
B.从热化学方程式看,石墨能量低,物质所含能量越低越稳定,石墨比金刚石稳定,故B错误;
C.2g氢气是1mol,放出285.8 kJ热量,则热化学方程式应为:2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1,故C正确;
D.中和热是强酸与强碱的稀溶液发生中和反应生成1mol水时放出的热量为57.3kJ/mol,浓硫酸溶解时放热,所以将含0.5mol H2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量大于57.3kJ,故D错误.
故选C.
点评 本题考查了状态不同的相同物质能量不同、能量越低越稳定、热化学方程式书写、中和热等知识,注意基础知识的掌握,题目难度不大.

练习册系列答案
 发散思维新课堂系列答案
发散思维新课堂系列答案
相关题目
10.元素的性质呈周期性变化的根本原因是( )
| A. | 元素的相对原子质量呈周期性变化 | |
| B. | 元素的原子半径呈周期性变化 | |
| C. | 元素的金属性和非金属性呈周期性变化 | |
| D. | 元素原子的核外电子排布呈周期性变化 |
11.下列叙述错误的是( )
| A. | 在加热搅拌条件下加入MgO,可除去MgCl2溶液中的Fe3+ | |
| B. | pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍 | |
| C. | 常温下,CH3COONa和CH3COOH的混合溶液中(pH=7):c(Na+)=c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-) | |
| D. | 常温下,Cd(OH)2和Co(OH)2的混合悬浊液中,c(Cd2+)是c(Co2+)的3.5倍已知:KSP[Cd(OH)2]=7.2×10-15,KSP[Co(OH)2]=1.8×10-15 |
8.关于钠及其化合物性质的叙述,正确的是( )
| A. | 相同条件下,在水中碳酸钠的溶解度小于碳酸氢钠的溶解度 | |
| B. | 氧化钠和过氧化钠都能与二氧化碳反应,生成物完全相同 | |
| C. | 碳酸氢钠固体中混有少量碳酸钠,可用加热的方法除去 | |
| D. | 质量相等的碳酸钠和碳酸氢钠分别与足量盐酸反应,后者产生气体多 |
5.巴豆酸的结构简式为CH3CH=CHCOOH,现有①氯化氢 ②溴水 ③纯碱溶液 ④2-丙醇 ⑤酸性KMnO4溶液.在一定条件与巴豆酸反应的物质的组合是( )
| A. | 只有②④⑤ | B. | 只有①③④ | C. | ①②③④⑤ | D. | 只有①②③④ |
12.将一定质量的铁、氧化铁、氧化铜的混合物粉末放入100mL 4.40mol/L盐酸中,充分反应后产生896mL H2(标准状况),残留固体1.28g.过滤,滤液中无Cu2+.将滤液加水稀释到200mL,测得其中c(H+)为0.400mol/L.则原混合物中单质铁的质量是( )
| A. | 2.24g | B. | 3.36g | C. | 5.60g | D. | 10.08g |
9.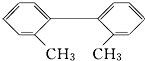 已知C-C键可以绕键轴自由旋转,对于结构简式为如图所示的烃,下列说法中正确的是( )
已知C-C键可以绕键轴自由旋转,对于结构简式为如图所示的烃,下列说法中正确的是( )
 已知C-C键可以绕键轴自由旋转,对于结构简式为如图所示的烃,下列说法中正确的是( )
已知C-C键可以绕键轴自由旋转,对于结构简式为如图所示的烃,下列说法中正确的是( )| A. | 分子中至少有8个碳原子处于同一平面上 | |
| B. | 分子中至少有9个碳原子处于同一平面上 | |
| C. | 该烃苯环上的一氯取代物最多有四种 | |
| D. | 该烃是苯的同系物 |
10.通常海水的pH=8.1,在稳定海水pH中起作用的离子是( )
| A. | Na+ | B. | HCO3- | C. | CO32- | D. | Cl- |
