��Ŀ����
12��A��B��C�����ֶ�����Ԫ�أ�����AԪ��ԭ��M���ϵ�������L����2�����ӣ�BԪ��ԭ�ӱ�AԪ��ԭ�ӵĵ��Ӳ��٣���֪BԪ����������븺���ϼ۵ľ���ֵ��ȣ�C Ԫ�ص������Ӻ�������Ų���Neԭ�Ӻ�������Ų���ͬ������֪������Ԫ�ؿ����BA2���ۻ������C2A�����ӻ���������������ش��������⣺��1��A��B��C��Ԫ�ص����Ʒֱ��ǣ�A��B̼��C�ƣ�
��2��������C2A�ĵ���ʽ��
 ��BA2�Ľṹʽ�ǣ�S=C=S��
��BA2�Ľṹʽ�ǣ�S=C=S����3��A��C������������Ӧ��ˮ����֮������ӷ�Ӧ����ʽΪH++OH-=H2O��
���� A��B��C�����ֶ�����Ԫ�أ�����AԪ��ԭ��M���ϵ�������L����2�����ӣ���M�������Ϊ8-2=6����AΪ��Ԫ�أ�BԪ��ԭ�ӱ�AԪ��ԭ�ӵĵ��Ӳ��٣���֪BԪ����������븺���ϼ۵ľ���ֵ��ȣ�B���ڵڶ����ڣ�����������Ϊ4����BΪ̼Ԫ�أ�C Ԫ�ص������Ӻ�������Ų���Neԭ�Ӻ�������Ų���ͬ��C���ڵ������ڣ��γ�C2A�����ӻ����CΪ+1�����ӣ���CΪNaԪ�أ��ݴ˽��
��� �⣺A��B��C�����ֶ�����Ԫ�أ�����AԪ��ԭ��M���ϵ�������L����2�����ӣ���M�������Ϊ8-2=6����AΪ��Ԫ�أ�BԪ��ԭ�ӱ�AԪ��ԭ�ӵĵ��Ӳ��٣���֪BԪ����������븺���ϼ۵ľ���ֵ��ȣ�B���ڵڶ����ڣ�����������Ϊ4����BΪ̼Ԫ�أ�C Ԫ�ص������Ӻ�������Ų���Neԭ�Ӻ�������Ų���ͬ��C���ڵ������ڣ��γ�C2A�����ӻ����CΪ+1�����ӣ���CΪNaԪ�أ�
��1��������������֪��AΪ��BΪ̼��CΪ�ƣ��ʴ�Ϊ����̼���ƣ�
��2��������C2AΪNa2S�����������������ӹ��ɣ�����ʽΪ ��������BA2ΪCS2��������̼ԭ������ԭ��֮���γ�2�Թ��õ��Ӷԣ��ṹʽΪS=C=S���ʴ�Ϊ��
��������BA2ΪCS2��������̼ԭ������ԭ��֮���γ�2�Թ��õ��Ӷԣ��ṹʽΪS=C=S���ʴ�Ϊ�� ��S=C=S��
��S=C=S��
��3��A��C������������Ӧ��ˮ����ֱ�ΪH2SO4��NaOH�����߷�Ӧ������������ˮ����Ӧ���ӷ���ʽΪH++OH-=H2O���ʴ�Ϊ��H++OH-=H2O��
���� ���⿼��ṹ����λ�ù�ϵ������ʽ�ȳ��û�ѧ����ȣ��ѶȲ����ƶ�Ԫ���ǽ���ؼ���ע�����֪ʶ���������գ�

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�| A�� | ��H��D��T��16O��17O��18O���ɵĹ���������ӵ���Է���������36�� | |
| B�� | H2��D2��T2��Ϊͬ�������� | |
| C�� | H2��D2��T2����ͬ�����µ��ܶȱ�Ϊ1��2��3 | |
| D�� | 뭡�뮷����˾۱������Ԫ�أ����ڻ�ѧ�仯 |
CO2��g��+H2��g��?CO��g��+H2O��g�� ��ƽ�ⳣ��K���¶�t�Ĺ�ϵ���£�
| t�� | 700 | 800 | 850 | 1000 | 1200 |
| K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
��b�����¶�Ϊ850�棬��2L�ܱ�������ͨ��1.0mol CO2��1.0mol H2����ƽ���CO2��ת����Ϊ50%��
��2�����������õ������£�NH4+����������Ӧ��������NO3-���������������仯ʾ��ͼ���£�

��a���ڶ�����Ӧ�Ƿ��ȷ�Ӧ��ѡ����ȡ������ȡ���
��b��1molNH4+��aq��ȫ��������NO3-��aq�����Ȼ�ѧ����ʽ��NH4+ ��aq��+2O2��g���TNO3- ��aq��+2H+��aq��+H2O��l����H=-346 kJ/mol��
��3����֪��
| ��ѧʽ | ����ƽ�ⳣ�� |
| HCN | K=4.9��10-10 |
| H2CO3 | K1=4.3��10-7��K2=5.6��10-11 |
����NaCN��Һ��ͨ������CO2��������Ӧ�����ӷ���ʽΪ��CN-+CO2+H2O=HCN+HCO3-��
��4����֪��Ksp��CaCO3��=4.96��10-9����������������Ӱ�죬�ֽ�0.40mol/L��Na2CO3��Һ��0.20mol/L��CaCl2��Һ�������ϣ����Ϻ���Һ��Ca2+Ũ��Ϊ4.96��10-8mol/L��
| A�� | K+��Al3+��Cl-��NO3- | B�� | K+��Fe3+��Cl-��SiO32- | ||
| C�� | H+��Fe2+��SO42-��Br2 | D�� | K+��Ag+��NH3•H2O��NO3- |
 ��
�� 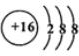 ��D��E���γ�һ������ԭ������������8���ӵķ��ӣ��÷��ӵĽṹʽΪS=C=S��D������Ԫ�ص��⻯���У��е���͵���H2S��
��D��E���γ�һ������ԭ������������8���ӵķ��ӣ��÷��ӵĽṹʽΪS=C=S��D������Ԫ�ص��⻯���У��е���͵���H2S�� ��A��B��C��D��E����ԭ���������������Ԫ�أ�ԭ��������С��30����A�Ļ�̬ԭ��2p�ܼ���3�������ӣ�C�Ļ�̬ԭ��2p�ܼ���1�������ӣ�Eԭ���������1�������ӣ���������3���ܼ��Ҿ��������ӣ�D��Eͬ���ڣ��۵�����Ϊ2����
��A��B��C��D��E����ԭ���������������Ԫ�أ�ԭ��������С��30����A�Ļ�̬ԭ��2p�ܼ���3�������ӣ�C�Ļ�̬ԭ��2p�ܼ���1�������ӣ�Eԭ���������1�������ӣ���������3���ܼ��Ҿ��������ӣ�D��Eͬ���ڣ��۵�����Ϊ2����