题目内容
4.已知乙二酸( HOOC-COOH)俗称草酸,它是一种易溶于水的二元弱酸,酸性强于碳酸,其盐草酸钙和草酸氢钙均为白色不溶物.无色晶体H2C2O4•2H2O称为草酸晶体,其熔点为101.5℃.草酸晶体失去结晶水得无水草酸,它在157℃升华.根据上述信息,回答下列问题.
(1)向盛有2mL饱和NaHCO3溶液的试管里加入少量乙二酸溶液,观察到的现象是有无色气泡产生,写出该反应的离子方程式:2HCO3-+H2C2O4=2H2O+2CO2↑+C2O42-.
(2)配平乙二酸与酸性KMnO4溶液反应的离子方程式:
2 MnO4-+5 H2C2O4+6H+-2Mn2++10CO2↑+8H2O
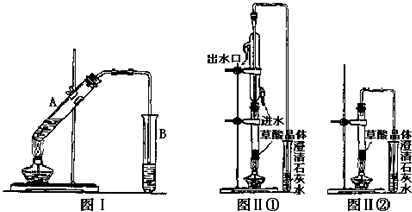
(3)向试管A中加入3mL乙醇,然后边振荡试管边加入2mL浓硫酸和2mL乙二酸溶液,按下图Ⅰ连接好装置,加热3-5min.在装有饱和Na2CO3溶液的试管B中有油状且带有香味的液体产生.B中导管口在液面上而不伸入液面下的原因是防止倒吸(或防止B中液体倒吸至A中).写出乙二酸与足量乙醇完全酯化的化学反应方程式
 .
.
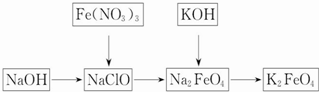
(4)已知草酸分解的化学方程式为:H2C2O4═$\frac{\underline{\;187℃\;}}{\;}$H2O+CO↑+CO2↑.
利用图Ⅱ①和图Ⅱ②加热草酸晶体,以验证草酸受热是否分解.连续加热一段时间后的现象是:
图Ⅱ①:试管里澄清石灰水先变浑浊,后又变澄清,其原因是草酸受热分解产生CO2,CO2使澄清石灰水变浑浊,过量CO2使浑浊又变澄清;
图Ⅱ②:试管里澄清石灰水只变浑浊,其原因是由于大量草酸蒸气逸出,与石灰水反应生成草酸钙沉淀;
能验证草酸受热分解的装置是①(填图Ⅱ中的编号“①”或“②”),理由是:增加了冷凝回流装置,避免草酸蒸气逸出(从装置的特点分析).
分析 (1)NaHCO3溶液和乙二酸溶液应生成C2O42-、二氧化碳、水;
(2)乙二酸与酸性KMnO4溶液的反应中,锰从+7价降为+2价,碳从+3价升为+4价,根据化合价升降法配平反应的离子方程式;
(3)乙二酸与足量乙醇反应生成乙二酸二乙酯,注意防止倒吸;
(4)如乙二酸分解,则生成二氧化碳气体,可使澄清石灰水变浑浊,过量CO2使浑浊又变澄清,加热时草酸蒸气逸出,草酸与氢氧化钙反应生成乙二酸钙沉淀;要能验证草酸受热分解,则要防止乙二酸的蒸气逸出,据此答题.
解答 解:(1)NaHCO3溶液和乙二酸溶液应生成C2O42-、二氧化碳、水,反应现象为有无色气泡产生,反应的离子方程式为 2 HCO3-+H2C2O4=2H2O+2CO2↑+C2O42-,
故答案为:有无色气泡产生; 2HCO3-+H2C2O4=2H2O+2CO2↑+C2O42-;
(2)乙二酸与酸性KMnO4溶液的反应中,锰从+7价降为+2价,碳从+3价升为+4价,根据化合价升降法配平反应的离子方程式为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,
故答案为:2,5,6,2,10,8;
(3B中导管口在液面上而不伸入液面下的原因是 防止倒吸(或防止B中液体倒吸至A中),乙二酸与足量乙醇完全酯化的化学反应方程式为 ,
,
故答案为:防止倒吸(或防止B中液体倒吸至A中); ;
;
(4)图Ⅱ①:试管里澄清石灰水先变浑浊,后又变澄清,其原因是草酸受热分解产生CO2,CO2使澄清石灰水变浑浊,过量CO2使浑浊又变澄清,图Ⅱ②中没有冷凝装置,乙二酸的蒸气逸出生成了乙二酸钙沉淀,所以试管里澄清石灰水只变浑浊,所以能验证草酸受热分解的装置是①,因为①中增加了冷凝回流装置,避免草酸蒸气逸出,
故答案为:草酸受热分解产生CO2,CO2使澄清石灰水变浑浊,过量CO2使浑浊又变澄清;由于大量草酸蒸气逸出,与石灰水反应生成草酸钙沉淀;①;增加了冷凝回流装置,避免草酸蒸气逸出.
点评 本题考查性质实验的探究,侧重于学生的分析、实验能力的考查,注意把握实验的原理、目的和操作方法,题目难度中等.

 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案| A. | 标准状况下,22.4L二氯甲烷的分子数约为NA个 | |
| B. | 25℃时,1L pH=13的Ba(OH)2溶液中含Ba2+的数目为0.1NA | |
| C. | 12g金刚石中含有的共价键数为2NA | |
| D. | 7.1g氯气与足量热烧碱溶液反应,转移电子数为0.1NA |
| A. | CO2→CO | B. | FeCl2→FeCl3 | C. | HCl→AgCl | D. | KI→I2 |
| A. | 通惰性气体增大压强,平衡正向移动 | |
| B. | 再加入X,反应吸收的热量增大 | |
| C. | 增加Y的物质的量,X的转化率减小 | |
| D. | 降低温度,c(Y):c(Z)的值变小 |

 正丁醚(CH3CH2CH2CH2OCH2CH2CH2CH3)是一种化工原料,常温下为无色液体,不溶于水,沸点为142.4℃,密度比水小.某实验小组利用如下装置来合成正丁醚(其它装置均略去),发生的主要反应为:
正丁醚(CH3CH2CH2CH2OCH2CH2CH2CH3)是一种化工原料,常温下为无色液体,不溶于水,沸点为142.4℃,密度比水小.某实验小组利用如下装置来合成正丁醚(其它装置均略去),发生的主要反应为:
 、
、 .
. 苯甲酸的分子式为C6H5COOH,分子结构为
苯甲酸的分子式为C6H5COOH,分子结构为 ,是苯环上的一个氢被羧基(-COOH)取代形成的化合物.其化学性质与乙酸类似,具有弱酸性,并可以和乙醇发生酯化反应生成苯甲酸乙酯.
,是苯环上的一个氢被羧基(-COOH)取代形成的化合物.其化学性质与乙酸类似,具有弱酸性,并可以和乙醇发生酯化反应生成苯甲酸乙酯. +CH3CH2OH$?_{△}^{浓硫酸}$
+CH3CH2OH$?_{△}^{浓硫酸}$ +H2O;实验中使用分水器的目的是分离出生成的水,有利于平衡向生成乙酸正丁酯的方向移动;.
+H2O;实验中使用分水器的目的是分离出生成的水,有利于平衡向生成乙酸正丁酯的方向移动;.