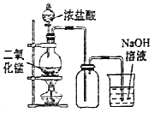
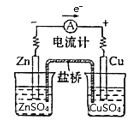
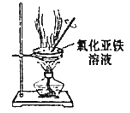
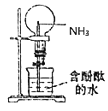
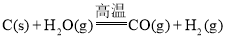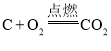题目内容
【题目】![]() 为二元弱酸,
为二元弱酸,![]() ,
,![]() ,设
,设![]() 溶液中
溶液中![]() 。室温下用NaOH溶液滴定
。室温下用NaOH溶液滴定![]() 溶液至终点。滴定过程得到的下列溶液中微粒的物质的量浓度关系一定正确的是( )
溶液至终点。滴定过程得到的下列溶液中微粒的物质的量浓度关系一定正确的是( )
A.![]() 溶液:
溶液:![]()
B.![]() 的溶液:
的溶液:![]()
C.![]() 的溶液:
的溶液:![]()
D.![]() 的溶液:
的溶液:![]()
【答案】D
【解析】
A.![]() 溶液中存在电荷守恒:
溶液中存在电荷守恒:![]() ,还存在物料守恒:
,还存在物料守恒:![]() ,二者结合可得:
,二者结合可得:![]() ,故A错误;
,故A错误;
B. ![]() 的溶液中,溶质为
的溶液中,溶质为![]() ,
,![]() 的水解平衡常数
的水解平衡常数![]() ,说明
,说明![]() 的电离程度大于其水解程度,则
的电离程度大于其水解程度,则![]() ,溶液中还存在水电离的氢离子,则
,溶液中还存在水电离的氢离子,则![]() ,所以正确的离子浓度大小为:
,所以正确的离子浓度大小为:![]() ,故B错误;
,故B错误;
C. 草酸与氢氧化钠溶液等体积、等浓度时满足:![]() ,但氢氧化钠溶液浓度不知,中和后溶液的体积不知,不能确定反应后浓度与
,但氢氧化钠溶液浓度不知,中和后溶液的体积不知,不能确定反应后浓度与![]() 的关系,所以该关系不一定不成立,故C错误;
的关系,所以该关系不一定不成立,故C错误;
D. ![]() 的溶液中,溶质为
的溶液中,溶质为![]() ,根据
,根据![]() 溶液中的质子守恒可得:
溶液中的质子守恒可得:![]() ,故D正确;
,故D正确;
综上所述,答案为D。

 阅读快车系列答案
阅读快车系列答案【题目】25℃下,部分弱酸的电离常数如表。下列有关说法不正确的是
弱酸 | HCOOH | HClO | H2S |
电离平衡常数(Ka) | Ka=1.0×10-4 | Ka=2.0×10-8 | Ka1=1.3×10-7 Ka2=7.1×10-15 |
A. 若 HCOONa和 HCOOH的混合溶液的pH=3,则c(HCOOH)/c(HCOO-)=10
B. 相同浓度的 HCOONa和 NaClO溶液中离子总浓度前者大
C. 任何浓度NaHS溶液中总存在:c(H2S)+c(H+)=c(OH-)+c(S2-)
D. 向 NaClO溶液中通入H2S发生的反应为2C1O-+H2S===S2-+2HClO
【题目】现有7瓶失去标签的试剂瓶,已知它们盛装的是有机液体,可能是乙醇、乙酸、苯、乙酸乙酯、油脂、葡萄糖溶液、蔗糖溶液。现通过如下实验来确定各试剂瓶中所装液体的名称。已知:![]() 。
。
实验步骤和方法 | 实验现象 |
①把7瓶液体依次标号为A、B、C、D、E、F、G后闻气味 | 只有F、G两种液体没有气味 |
②各取少量于试管中加水稀释 | 只有C、D、E三种液体不溶解而浮在水上层 |
③分别取少量7种液体于试管中加新制的Cu(OH)2悬浊液并加热 | 只有B使沉淀溶解,F中产生砖红色沉淀 |
④各取C、D、E少量于试管中,加稀NaOH溶液并加热 | 只有C中仍有分层现象,且在D的试管中闻到特殊香味 |
(1)试写出下列标号代表的液体名称:
A________,B________,C________,D________,E________,F________,G________。
(2)写出在F中加入新制Cu(OH)2悬浊液并加热的化学方程式:________________。