题目内容
16gO2和16gO3所含的分子数之比是 ,原子数之比是 ,所含质子数之比为 .
考点:物质的量的相关计算
专题:计算题
分析:根据n=
计算16gO2和16gO3的物质的量,进而计算分子数之比,O2和O3都由O原子构成,二者质量相等,则含有O原子数目相等,含有质子相等.
| m |
| M |
解答:
解:16gO2的物质的量=
=0.5mol,16gO3的物质的量=
=
mol,16gO2和16gO3所含的分子数之比=0.5mol:
mol=3:2,O2和O3都由O原子构成,二者质量相等,则含有O原子数目相等,含有质子相等,即含有原子数之比是1:1,所含质子数之比为1:1,
故答案为:3:2;1:1;1:1.
| 16g |
| 32g/mol |
| 16g |
| 48g/mol |
| 1 |
| 3 |
| 1 |
| 3 |
故答案为:3:2;1:1;1:1.
点评:本题考查物质的量有关计算,比较基础,注意对公式的理解与灵活应用.

练习册系列答案
相关题目
 热激活电池可用作火箭、导弹的工作电源.其基本结构如图所示,作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能.该电池的总反应方程式为:PbSO4+2LiCl+Ca?CaCl2+Li2SO4+Pb.下列有关说法正确的是( )
热激活电池可用作火箭、导弹的工作电源.其基本结构如图所示,作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能.该电池的总反应方程式为:PbSO4+2LiCl+Ca?CaCl2+Li2SO4+Pb.下列有关说法正确的是( )| A、电子由钙电极流出经无水LiCl-KCl电解质流向硫酸铅电极 |
| B、常温时,在正负极间接上电流表或检流计,指针不偏转 |
| C、放电过程中,Li+向负极移动 |
| D、每转移0.1mol电子,理论上生成20.7g Pb |
室温下,0.1mol?L-1 HF溶液与0.1mol?L-1 NaOH溶液等体积混合(忽略混合前后溶液体积的变化),则下列有关混合后的溶液中离子浓度的叙述正确的是( )
| A、由水电离产生的c(H+)为1.0×10-7mol?L-1 |
| B、c(F-)+c(HF)=c(Na+) |
| C、升高温度,c(F-)增大 |
| D、c(F-)>c(Na+)>c(H+)>c(OH-) |

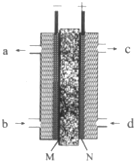 甲醇是燃料电池的常见原料,现已熔融的K2CO3为电解质,以甲醇为燃料,空气为氧化剂,以具有催化作用和导电性能的稀土金属材料为电极.如图是甲醇燃料电池模型,试回答下列问题:
甲醇是燃料电池的常见原料,现已熔融的K2CO3为电解质,以甲醇为燃料,空气为氧化剂,以具有催化作用和导电性能的稀土金属材料为电极.如图是甲醇燃料电池模型,试回答下列问题: 已知:H2(g)+
已知:H2(g)+