题目内容
镉镍可充电电池工作化学原理如下:Cd+2NiO(OH)+2H2O
Cd(OH)2+2Ni(OH)2,由此可知,该电池放电时的正极是( )
| 充电 |
| 放电 |
| A、Cd |
| B、NiO(OH) |
| C、Cd(OH)2 |
| D、Ni(OH)2 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:根据总反应式结合化合价的变化判断被氧化和被还原的物质,原电池中正极发生还原反应..
解答:
解:由Cd+2NiO(OH)+2H2O
Cd(OH)2+2Ni(OH)2可知,由方程式可知,Cd元素化合价升高,被氧化,为负极;NiO(OH)中Ni元素的化合价降低被还原,为正极,
故选B.
| 充电 |
| 放电 |
故选B.
点评:本题考查原电池反应,题目难度不大,注意根据化合价的变化判断原电池的正负极反应.

练习册系列答案
相关题目
下列四种工业生产,不需用石灰石作为一种原料的是( )
| A、用海水为原料制镁 |
| B、冶炼生铁 |
| C、制漂白粉 |
| D、铝土矿中提取铝 |
蒸馏分离时,会导致收集到的产品中混有高沸点杂质的图示是( )
A、 |
B、 |
C、 |
D、 |
T℃时,将气体X与气体Y置于一密闭容器中,反应生成气体Z,反应过程中各物质的 浓度变化如图(Ⅰ)所示.保持其它条件不变,在T1、T2两种温度下,Y的体积分数变化如图(Ⅱ)所示,下列结论正确的是( )
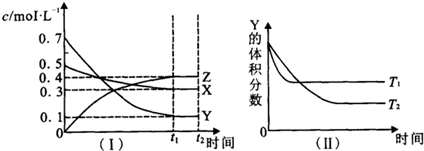

| A、图(Ⅱ)中T1>T2,则正反应是吸热反应 |
| B、t2 min时,保持压强不变,通入稀有气体,平衡向正反应方向移动 |
| C、其它条件不变,升高温度,正、逆反应速率均增大,且X的转化率增大 |
| D、T℃时,若密闭容器中各物质起始浓度为:0.4mol?L-1 X、0.4mol?L-1 Y、0.2mol/L Z保持其他条件不变,达到平衡时z的浓度为0.4 mol?L-1 |
下列有关铝及其化合物的叙述正确的是( )
| A、铝粉与氧化镁共热可制取金属镁 |
| B、足量铝分别与含1mol HCl、1mol NaOH的溶液反应,产生相同量的氢气 |
| C、在浓硝酸中加入等体积的浓硫酸后,立即加入铝片,铝片表面发生钝化 |
| D、工业上用电解熔融Al2O3的方法冶炼铝 |
蒸干下列物质可以得到溶质本身的是( )
| A、AlCl3溶液 |
| B、NaHCO3溶液 |
| C、Fe2(SO4)3溶液 |
| D、CuCl2溶液 |
下列有关溶液性质的叙述,正确的是( )
| A、强电解质在水中溶解度一定大于弱电解质 |
| B、让一束光线通过蛋白质溶液,会产生丁达尔现现象 |
| C、75mL 2mol/L氯化铵溶液的c(Cl-)与50mL 1 mol/L氯化锅溶液中的c(Cl-)相等 |
| D、浓度为1mol/L的醋酸溶液lL,欲使其浓度变为2mol/L,将溶液加热蒸发浓缩至0.5L |