题目内容
8. 空气质量与我们的健康息息相关,目我国通过检测6项污染物的质量浓度来计算空气质量指数(AQI),SO2、NO2、和CO是其中3项中的污染物.
空气质量与我们的健康息息相关,目我国通过检测6项污染物的质量浓度来计算空气质量指数(AQI),SO2、NO2、和CO是其中3项中的污染物.(1)上述3种气体直接排入空气后会引起酸雨的气体有SO2、NO2(填化学式).
(2)处理酸雨市场采用NaClO2溶液作为吸收剂,可同时对烟气进行脱硫、脱硝,其中脱硫反应ClO2-+2SO32-?2SO42-+Cl-,该反应的平衡常数K的表达式为K=$\frac{c(C{l}^{-}){c}^{2}(S{O}_{4}^{2-})}{c(Cl{O}_{2}^{-}){c}^{2}(S{O}_{3}^{2-})}$;
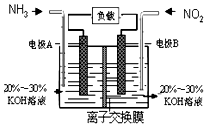
(3)利用反应6NO2+8NH3═7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示,写出电极A的电极方程式2NH3+6e-+6OH-=N2+6H2O,当标况下有4.48L被处理时,通过电极B的电子数为0.8NA.
分析 (1)从空气污染的角度分析,利用酸雨形成的过程相关知识解决;
(2)反应的平衡常数表达式为生成物的浓度幂之积比上反应物浓度幂之积;
(3)根据方程式知,6NO2+8NH3═7N2+12H2O中NO2中N元素化合价由+4价变为0价、NH3中N元素化合价由-3价变为0价,所以NO2发生还原反应、NH3发生氧化反应,则A是负极、B是正极,负极电极方程式为2NH3-6e-+6OH-=N2+6H2O,正极反应式为2NO2+8e-+4H2O=8OH-+N2,由此分析解答.
解答 解:(1)SO2、NO2和CO中,能和空气中的水蒸气反应的有SO2、NO2,SO2+H2O=H2SO3 H2SO3进一步被氧气氧化为硫酸,3NO2+H2O=2HNO3+NO,硫酸和硝酸融入雨水,形成酸雨,在空气中CO不能与水反应,故答案为:SO2、NO2;
(2)反应的平衡常数表达式为生成物的浓度幂之积比上反应物浓度幂之积,所以ClO2-+2SO32-?2SO42-+Cl-,平衡常数为:K=$\frac{c(C{l}^{-}){c}^{2}(S{O}_{4}^{2-})}{c(Cl{O}_{2}^{-}){c}^{2}(S{O}_{3}^{2-})}$,
故答案为:K=$\frac{c(C{l}^{-}){c}^{2}(S{O}_{4}^{2-})}{c(Cl{O}_{2}^{-}){c}^{2}(S{O}_{3}^{2-})}$;
(3)根据方程式知,6NO2+8NH3═7N2+12H2O中NO2中N元素化合价由+4价变为0价、NH3中N元素化合价由-3价变为0价,所以NO2发生还原反应、NH3发氧化反应,则A是负极、B是正极,负极电极方程式为2NH3-6e-+6OH-=N2+6H2O,所以电极A极反应式为2NH3-6e-+6OH-═N2+6H2O,当有4.48 L NO2 被处理时,参加反应的NO2物质的量为0.2mol,转移电子物质的量=0.2mol×[4-0]=0.8mol,
故答案为:2NH3+6e-+6OH-=N2+6H2O; 0.8NA.
点评 本题考查化学电源新型电池,为高频考点,明确化学反应中化合价升降与正负极的关系是解本题关键,难点是电极反应式的书写,注意电子流向判断,题目难度不大.

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案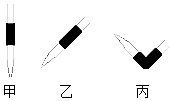 某学生用0.4000mol/L NaOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
某学生用0.4000mol/L NaOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:(A)用标准溶液润洗滴定管2-3次
(B)取标准NaOH溶液注入碱式滴定管至0刻度以上2-3cm
(C)把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液
(D)调节液面至0或0刻度以下,记下读数
(E)移取10.00mL待测的盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞
(F)在锥形瓶下垫一张白纸,用标准NaOH溶液滴定至终点,记下滴定管液面的刻度
完成以下填空:
(1)排去碱式滴定管中气泡的方法应采用如图的丙操作,然后轻轻挤压玻璃球使尖嘴部分充满碱液.
(2)E操作中在锥形瓶下垫一张白纸的作用是便于准确判断终点时颜色的变化情况
(3)实验中,用左手控制活塞(填仪器及名称),眼睛应注视锥形瓶内溶液颜色的变化,直至滴定终点.
(4)几次滴定消耗NaOH溶液的体积如表:
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 18.80 | 19.95 |
(5)用标准的NaOH滴定未知浓度的盐酸,选用酚酞为指示剂,造成测定结果偏高的原因可能是:CD (错选全扣)
A.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
B.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
C.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
D.未用标准液润洗碱式滴定管
E.碱式滴定管滴定前无气泡,滴定后尖嘴部分有气泡.
| A. | 密度一定相同 | B. | 分子数一定相同 | ||
| C. | 原子数一定相同 | D. | 物质的量一定相同 |
| A. | 含等物质的量的Fe3+、Cu2+、H+的溶液中加入锌粉:Fe3+、Cu2+、H+、Fe2+ | |
| B. | 含等物质的量的FeBr2、Fel2的溶液中,缓慢通入氯气:I-、Fe2+、Br- | |
| C. | 含等物质的量的Ba(OH)2、KOH的溶液中,缓慢通入CO2:Ba(OH)2、KOH、BaCO3、K2CO3 | |
| D. | 含等物质的量的AlO2-、OH-、CO32-的溶液中,逐滴加入盐酸:OH-、AlO2-、CO32- |
| A. | 加入碳酸钠溶液产生白色沉淀,再加盐酸,白色沉淀消失,一定有Ca2+ | |
| B. | 某溶液与NaOH溶液共热,产生使湿润红色石蕊试纸变蓝气体,说明原溶液中存在NH4+ | |
| C. | 某溶液加入稀盐酸产生无色气体,将气体通入澄清石灰水,溶液变浑浊,则一定含有CO32- | |
| D. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- |
| A. | NO2和N2O4浓度相等 | B. | NO2和N2O4分子数之比为2:1 | ||
| C. | 体系颜色不再发生变化 | D. | N2O4不再分解 |
| A. | NaOH | B. | Ba(OH)2 | C. | AgNO3 | D. | HCl |
| A. | Na2SO4=Na2++SO42- | B. | MgCl2=Mg2++Cl- | ||
| C. | HNO3=H++3NO- | D. | Ba(OH)2=Ba2++2OH- |
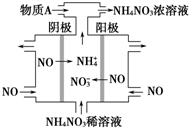 2015年3月,全国“两会”代表委员就我国“雾霾”治理积极建言献策.科学家研究表明氮氧化物与悬浮在大气中的盐粒子相互作用时能产生“二次雾霾”,涉及的反应有:
2015年3月,全国“两会”代表委员就我国“雾霾”治理积极建言献策.科学家研究表明氮氧化物与悬浮在大气中的盐粒子相互作用时能产生“二次雾霾”,涉及的反应有: