题目内容
相同条件下,质量相等的镁和铝分别和足量的稀盐酸起反应后
- A.铝放出的氢气较多
- B.镁放出的氢气较多
- C.镁消耗的HCl较多
- D.铝消耗的HCl较少
A
分析:根据n= 知,等质量的镁和铝,其物质的量与摩尔质量成反比,根据三种金属的化合价可得与盐酸反应的关系式分别为:Mg~2HCl~H2,Al~3HCl~
知,等质量的镁和铝,其物质的量与摩尔质量成反比,根据三种金属的化合价可得与盐酸反应的关系式分别为:Mg~2HCl~H2,Al~3HCl~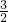 H2,根据反应的方程式计算.
H2,根据反应的方程式计算.
解答:根据n= 知,等质量的镁和铝,其物质的量=
知,等质量的镁和铝,其物质的量=
 ,相同条件下产生的氢气的物质的量之比=
,相同条件下产生的氢气的物质的量之比= :
: =3:4,所以铝放出的氢气较多,消耗酸的物质的量之比=
=3:4,所以铝放出的氢气较多,消耗酸的物质的量之比= :
: =3:4,所以铝消耗酸较多,故选A.
=3:4,所以铝消耗酸较多,故选A.
点评:本题考查化学方程式的计算,注意根据化学方程式判断有关反应的量的关系,明确物质之间量的关系是解本题关键,难度不大.
分析:根据n=
 知,等质量的镁和铝,其物质的量与摩尔质量成反比,根据三种金属的化合价可得与盐酸反应的关系式分别为:Mg~2HCl~H2,Al~3HCl~
知,等质量的镁和铝,其物质的量与摩尔质量成反比,根据三种金属的化合价可得与盐酸反应的关系式分别为:Mg~2HCl~H2,Al~3HCl~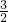 H2,根据反应的方程式计算.
H2,根据反应的方程式计算.解答:根据n=
 知,等质量的镁和铝,其物质的量=
知,等质量的镁和铝,其物质的量=
 ,相同条件下产生的氢气的物质的量之比=
,相同条件下产生的氢气的物质的量之比= :
: =3:4,所以铝放出的氢气较多,消耗酸的物质的量之比=
=3:4,所以铝放出的氢气较多,消耗酸的物质的量之比= :
: =3:4,所以铝消耗酸较多,故选A.
=3:4,所以铝消耗酸较多,故选A.点评:本题考查化学方程式的计算,注意根据化学方程式判断有关反应的量的关系,明确物质之间量的关系是解本题关键,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
相同质量的铝分别与足量的稀盐酸和氢氧化钠溶液反应,下列说法不正确的是( )
| A、相同条件下,产生气体的体积相等 | B、生成的铝的化合物的物质的量相等 | C、消耗酸和碱的物质的量相等 | D、相同条件下,转移的电子数相等 |
