题目内容
【题目】一定条件下,在体积为3L的密闭容器中化学反应CO(g)+2H2(g)![]() CH3OH(g)达到平衡状态。
CH3OH(g)达到平衡状态。
(1)该反应的平衡常数表达式K=______;根据图,升高温度,K值将______(填“增大”“减小”或“不变”)。

(2)500℃时,从反应开始达到化学平衡,以H2的浓度变化表示的化学反应速率是______(用nB、tB表示)。
(3)判断该可逆反应达到化学平衡状态的标志是_________(填字母,下同)。
a.v生成(CH3OH)=v消耗(CO)
b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变
d.CO、H2、CH3OH的浓度之比为1:2:1
(4)300℃时,将容器的容积压缩到原来的![]() ,在其他条件不变的情况下,对平衡体系产生的影响是______(填字母)。
,在其他条件不变的情况下,对平衡体系产生的影响是______(填字母)。
a.c(H2)减小
b.正反应速率加快,逆反应速率减慢
c.CH3OH的物质的量增加
d.重新平衡时![]() 减小
减小
【答案】K=![]() 减小
减小 ![]() c cd
c cd
【解析】
(1)根据化学平衡常数的含义书写表达式,结合温度与平衡移动的关系分析K的变化规律;
(2)速率之比等于方程式的计量系数之比,先求出用甲醇表示的速率之比再根据速率之比等于方程式的计量系数之比求解;
(3)判断可逆反应达到化学平衡状态的标志,一个是“等”也就是正反应速率等于逆反应速率;一个是“定”也就是物质的百分含量等保持不变,抓住反应中时刻改变的量不变时,反应达到平衡;
(4)缩小容器的体积相当于加压,平衡向系数减小的方向移动,然后根据平衡的移动分析求解。
(1)可逆反应CO(g)+2H2(g)![]() CH3OH(g)的化学平衡常数K=
CH3OH(g)的化学平衡常数K=![]() ,从图象可知温度升高,CH3OH的平衡含量降低,说明升高温度平衡逆向移动,因此该反应的化学平衡常数K值减小;
,从图象可知温度升高,CH3OH的平衡含量降低,说明升高温度平衡逆向移动,因此该反应的化学平衡常数K值减小;
(2)v(CH3OH)= ,由于同一反应用不同物质表示反应速率时,速率比等于化学方程式中的化学计量数的比,所以v(H2)=2v(CH3OH)=2×
,由于同一反应用不同物质表示反应速率时,速率比等于化学方程式中的化学计量数的比,所以v(H2)=2v(CH3OH)=2×![]() ;
;
(3)a.都表示的正反应方向的速率关系不能判断正逆反应速率是否相等,a错误;
b.ρ=![]() ,m是气体的总质量,反应过程中始终保持不变,v是定值,所以ρ始终不变,不能用来判断是否达到平衡,b错误;
,m是气体的总质量,反应过程中始终保持不变,v是定值,所以ρ始终不变,不能用来判断是否达到平衡,b错误;
c.M=![]() ,m是气体的总质量,反应过程中始终保持不变,n是气体的物质的量之和,反应前后气体系数不同,故可根据物质的相对分子质量M可以用来判断是否达到平衡,c正确;
,m是气体的总质量,反应过程中始终保持不变,n是气体的物质的量之和,反应前后气体系数不同,故可根据物质的相对分子质量M可以用来判断是否达到平衡,c正确;
d.各种物质的浓度之比等于方程式中相应物质的化学计量数之比时,反应可能处于平衡状态,也可能未处于平衡状态,这与反应开始时加入的物质的量的多少有关,因此不可以作为达到平衡的标准,d错误;
故合理选项是c;
(4)缩小容器的体积相当于加压,平衡向系数减小的方向移动。
a.增大压强,c(H2)应该先增大后减小,但是比原来的大,a错误;
b.缩小体积反应物、生成物浓度都增大,所以正、逆反应速率都增大,b错误;
c.缩小容器的体积相当于加压,平衡向系数减小的方向移动,即向正方向移动,甲醇的物质的量增加,c正确;
d.化学平衡常数K=![]() ,
,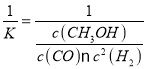 =
=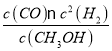 ,缩小容器的体积,c(CO)浓度先是由于缩小容积而变大后由于平衡正向移动而变小,但是最终达到平衡时比原来的大,因为温度不变所以
,缩小容器的体积,c(CO)浓度先是由于缩小容积而变大后由于平衡正向移动而变小,但是最终达到平衡时比原来的大,因为温度不变所以![]() 不变,所以重新平衡时
不变,所以重新平衡时![]() 减小,d正确;
减小,d正确;
故合理选项是cd。

 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案