题目内容
下列离子方程式的书写正确的是( )
| A、向碳酸氢钙溶液中加入足量氨水:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O |
| B、次氯酸钠溶液通入二氧化硫气体:2ClO-+SO2+H2O═2HClO+SO32- |
| C、向KI与稀硫酸的混合溶液中通入氧气:4H++O2+4I-═2I2+2H2O |
| D、小苏打溶液中加入过量石灰水:2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O |
考点:离子方程式的书写
专题:
分析:A.一水合氨为弱电解质,应保留化学式;
B.次氯酸根离子具有强的氧化性,能够氧化亚硫酸根离子;
C.向KI与稀硫酸的混合溶液中通入氧气,碘离子被氧化生成单质碘;
D.小苏打溶液中加入过量石灰水,反应生成碳酸钙和氢氧化钠和水.
B.次氯酸根离子具有强的氧化性,能够氧化亚硫酸根离子;
C.向KI与稀硫酸的混合溶液中通入氧气,碘离子被氧化生成单质碘;
D.小苏打溶液中加入过量石灰水,反应生成碳酸钙和氢氧化钠和水.
解答:
解:A.向碳酸氢钙溶液中加入足量氨水,离子方程式:Ca2++2HCO3-+2NH3?H2O═CaCO3↓+CO32-+2H2O+2NH4+,故A错误;
B.少量二氧化硫通入次氯酸钠溶液中,离子方程式:SO2+3ClO-+H2O=SO42-+2HClO+Cl-,故B错误;
C.向KI与稀硫酸的混合溶液中通入氧气,离子方程式:4H++O2+4I-═2I2+2H2O,故C正确;
D.小苏打溶液中加入过量石灰水,离子方程式:HCO3-+Ca2++OH-=CaCO3↓+H2O,故D错误;
故选:C.
B.少量二氧化硫通入次氯酸钠溶液中,离子方程式:SO2+3ClO-+H2O=SO42-+2HClO+Cl-,故B错误;
C.向KI与稀硫酸的混合溶液中通入氧气,离子方程式:4H++O2+4I-═2I2+2H2O,故C正确;
D.小苏打溶液中加入过量石灰水,离子方程式:HCO3-+Ca2++OH-=CaCO3↓+H2O,故D错误;
故选:C.
点评:本题考查了离子方程式的书写,题目难度不大,明确发生的化学反应是解题关键,注意离子方程式书写应遵循客观事实、遵循原子个数守恒定律、遵循电荷守恒定律,注意反应物用量对反应的影响,选项D为易错选项.

练习册系列答案
相关题目
下列各组物质,前者属于电解质,后者属于非电解质的是( )
| A、KCl晶体、BaC03 |
| B、铁、二氧化硫 |
| C、液态的醋酸、乙醇 |
| D、熔融的K2SO4、盐酸溶液 |
以下有关元素性质的说法不正确的是( )
| A、具有下列电子排布式的原子中,①1s22s22p63s23p2②1s22s22p3 ③1s22s22p2 ④1s22s22p63s23p4 原子半径最大的是① |
| B、具有下列价电子排布式的原子中,①3s23p1 ②3s23p2 ③3s23p3 ④3s23p4,第一电离能最大的是③ |
| C、①Na、K、Rb ②O、S、Se ③Na、P、Cl,元素的电负性随原子序数增大而递增的是③ |
| D、某元素气态基态原子的逐级电离能分别为738、1451、7733、10540、13630、17995、21703,当它与氯气反应时可能生成的阳离子是X3+ |
用NA表示阿伏加德罗常数的数值,则下列说法中正确的是( )
| A、常温常压下,18gH2O所含原子数为NA |
| B、常温常压下,11.2L氧气含原子数为NA |
| C、2.3g金属钠变为钠离子失去0.1NA电子 |
| D、在同温同压时,相同体积的任何气体单质都含有相同数目的原子 |
下列电离方程式中,不正确的是( )
| A、NaCl=Na++Cl- |
| B、HClO?ClO-+H+ |
| C、NH3?H2O=NH4++OH- |
| D、NaOH=Na++OH- |
下列化学用语正确的是( )
A、中子数为20的氯原子:
| ||||
| B、硫酸的电离方程式:H2SO4=H22++SO42- | ||||
| C、漂白粉的有效成分:CaCl2 | ||||
D、铝离子结构示意图: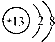 |
已知N元素最低化合价是-3价,最高化合价是+5价,那么下列物质中的N元素只具有氧化性的是( )
| A、NH3 |
| B、N2 |
| C、NO2 |
| D、HNO3 |
已知:①H2O(g)═H2O(l)△H1=-Q1 kJ?mol-1
②CH3OH(g)═CH3OH(l)△H2=-Q2 kJ?mol-1
③2CH3OH(g)+3O2(g)═2CO2(g)+4H2O(g)△H3=-Q3 kJ?mol-1(Q1、Q2、Q3均大于0)
若要使32g液态甲醇完全燃烧,最后恢复到室温,放出的热量为(单位:kJ)( )
②CH3OH(g)═CH3OH(l)△H2=-Q2 kJ?mol-1
③2CH3OH(g)+3O2(g)═2CO2(g)+4H2O(g)△H3=-Q3 kJ?mol-1(Q1、Q2、Q3均大于0)
若要使32g液态甲醇完全燃烧,最后恢复到室温,放出的热量为(单位:kJ)( )
| A、Q1+Q2+Q3 |
| B、0.5Q3-Q2+2Q1 |
| C、0.5Q3+Q2-2Q1 |
| D、0.5(Q1+Q2+Q3) |