题目内容
10.下列属于吸热反应的是( )| A. | 可燃冰的燃烧 | B. | 盐酸与氢氧化钠反应 | ||
| C. | 石灰石高温分解 | D. | 锌与稀硫酸反应 |
分析 常见的放热反应有:所有的物质燃烧、所有金属与酸反应、金属与水反应,所有中和反应;绝大多数化合反应和铝热反应;
常见的吸热反应有:绝大数分解反应,个别的化合反应(如C和CO2),少数分解置换以及某些复分解(如铵盐和强碱).
解答 解:A.可燃冰的燃烧属于放热反应,故A错误;
B.盐酸与氢氧化钠反应是中和反应,属于放热反应,故B错误;
C.碳酸钙高温下分解是吸热反应,故C正确;
D.锌和稀硫酸反应是金属与酸的反应,属于放热反应,故D错误;
故选C.
点评 本题考查吸热反应和放热反应,难度不大,明确中学化学中常见的吸热或放热的反应是解题的关键.

练习册系列答案
相关题目
18.“向海洋进军”,已成为世界许多国家发展的战略口号,海水中通常含有较多的Ca2+、Mg2+、$SO_4^{2-}$等杂质离子,以海盐为原料的氯碱厂电解饱和食盐水制取NaOH的工艺流程如下:
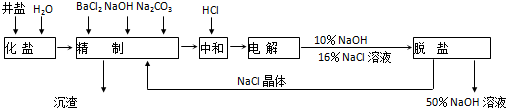
依据如图,完成下列填空:
(1)在电解过程中,与电源正极相连的电极的电极反应式为2Cl--2e-=Cl2↑;
(2)电解过程的总反应的化学方程式2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑.
(3)电解槽阳极产物可用于制漂白粉、生产盐酸、自来水消毒、制高纯硅、合成塑料等(任写2种)(至少写出两种用途).
(4)工业食盐含Ca2+、Mg2+等杂质,精制过程中除去这2种离子所发生反应的离子方程式为:Ca2++CO32-=CaCO3↓、Mg2++2OH-=Mg(OH)2↓.
(5)如果粗盐中SO42-含量较高,必须添加钡试剂除去SO42-,该钡试剂可以是a、c
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
(6)为了有效除去Ca2+、Mg2+、SO42-加入试剂的合理顺序为b、c
a.先加NaOH,后加Na2CO3,再加钡试剂
b.先加NaOH,后加钡试剂,再加Na2CO3
c.先加钡试剂,后加NaOH,再加Na2CO3
(7)已知NaOH、NaCl在水中的溶解度数据如下表:
根据上述数据,脱盐工序中利用通过蒸发结晶、趁热过滤(填操作名称)除去NaCl.

依据如图,完成下列填空:
(1)在电解过程中,与电源正极相连的电极的电极反应式为2Cl--2e-=Cl2↑;
(2)电解过程的总反应的化学方程式2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑.
(3)电解槽阳极产物可用于制漂白粉、生产盐酸、自来水消毒、制高纯硅、合成塑料等(任写2种)(至少写出两种用途).
(4)工业食盐含Ca2+、Mg2+等杂质,精制过程中除去这2种离子所发生反应的离子方程式为:Ca2++CO32-=CaCO3↓、Mg2++2OH-=Mg(OH)2↓.
(5)如果粗盐中SO42-含量较高,必须添加钡试剂除去SO42-,该钡试剂可以是a、c
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
(6)为了有效除去Ca2+、Mg2+、SO42-加入试剂的合理顺序为b、c
a.先加NaOH,后加Na2CO3,再加钡试剂
b.先加NaOH,后加钡试剂,再加Na2CO3
c.先加钡试剂,后加NaOH,再加Na2CO3
(7)已知NaOH、NaCl在水中的溶解度数据如下表:
| 温度/℃ | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
| NaOH/g | 109 | 118 | 129 | 146 | 177 | 300 | 313 | 318 | 337 |
| NaCl/g | 36 | 36.3 | 36.6 | 37 | 37.3 | 37.8 | 38.4 | 39 | 39.8 |
2.下列离子方程式正确的是( )
| A. | 澄清的石灰水与稀盐酸反应Ca(OH)2+2H+═Ca2++2H2O | |
| B. | 少量金属钠放入冷水中:Na+2H2O═Na++2OH-+H2↑ | |
| C. | 氧化铜溶于硫酸:O2-+2H+═H2O | |
| D. | 碳酸钙溶于醋酸CaCO3+2CH3COOH═Ca2++2CH3COO-+H2O+CO2↑ |
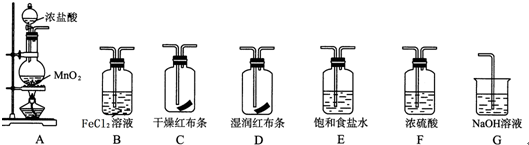
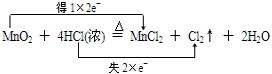 .
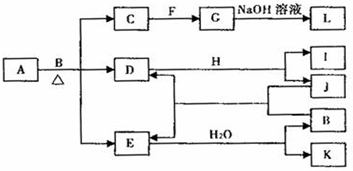
.




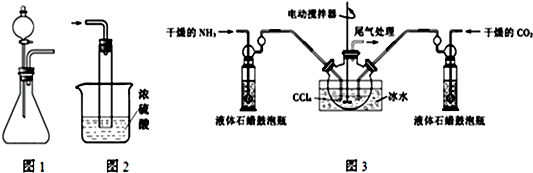
 ;V的氢氧化物作弱酸时有类似TR4-的离子产生,其电离方程式为Al(OH)3+H2O?H++[Al(OH)4]-.
;V的氢氧化物作弱酸时有类似TR4-的离子产生,其电离方程式为Al(OH)3+H2O?H++[Al(OH)4]-.