题目内容
已知①硫酸比次氯酸稳定②硫酸的酸性弱于高氯酸③H2S比HCl易被氧化④HCl比H2S更容易由单质合成⑤盐酸的酸性比H2S酸性强.上述事实能够说明硫的非金属性比氯弱的是( )
| A、①②③ | B、③④⑤ |
| C、②③④ | D、①③⑤ |
考点:非金属在元素周期表中的位置及其性质递变的规律
专题:元素周期律与元素周期表专题
分析:比较元素的非金属性强弱可根据:元素对应最高价氧化物的水化物的酸性;氢化物的还原性、稳定性强弱;与氢气反应的难易程度以及单质的氧化性的强弱等角度.
解答:
解:①硫酸比次氯酸稳定,但Cl的非金属性比S强,不能用来比较非金属性强弱,故①错误;
②元素对应最高价氧化物的水化物的酸性越强,对应的元素的非金属性越强,可说明非金属性Cl>S,故②正确;
③元素的非金属性越强,对应单质的氧化性越强,则氢化物的还原性越弱,H2S比HCl易被氧化,可说明非金属性Cl>S,故③正确;
④元素的非金属性越强,单质与氢气反应越剧烈,HCl比H2S更容易由单质合成,可说明非金属性Cl>S,故④正确;
⑤比较元素的非金属性应用元素对应最高价氧化物的水化物的酸性强弱比较,不能根据氢化物的酸性强弱比较,例如
盐酸的酸性比氢硫酸强,非金属性:Cl>S,但HF溶液的酸性比HCl弱,但非金属性:F>Cl,故⑤错误;
所以正确的有②③④;
故选C.
②元素对应最高价氧化物的水化物的酸性越强,对应的元素的非金属性越强,可说明非金属性Cl>S,故②正确;
③元素的非金属性越强,对应单质的氧化性越强,则氢化物的还原性越弱,H2S比HCl易被氧化,可说明非金属性Cl>S,故③正确;
④元素的非金属性越强,单质与氢气反应越剧烈,HCl比H2S更容易由单质合成,可说明非金属性Cl>S,故④正确;
⑤比较元素的非金属性应用元素对应最高价氧化物的水化物的酸性强弱比较,不能根据氢化物的酸性强弱比较,例如
盐酸的酸性比氢硫酸强,非金属性:Cl>S,但HF溶液的酸性比HCl弱,但非金属性:F>Cl,故⑤错误;
所以正确的有②③④;
故选C.
点评:本题考查非金属性的比较角度,题目难度不大,但易错,注意把握比较非金属性的方法,非金属性属于化学性质,与物理性质无关,解答时注意抓住反例证明.

练习册系列答案
相关题目
如图为A、B两种物质间的转化关系(其中C、D是反应物,部分产物已省略).以下判断不正确的是( )


| A、若A是AlCl3,则C既可以是强碱,也可以是弱碱 |
| B、若A是碱性气体,则A和C可能发生氧化还原反应,也可能发生非氧化还原反应 |
| C、上述变化过程中,A可以是酸、碱、盐,也可以是单质或氧化物 |
| D、若A→B是氧化还原反应,则C、D在上述转化过程中一定有一种为氧化剂,另一种为还原剂 |
下列叙述正确的是( )
①久置于空气中的氢氧化钠溶液,加足量盐酸时有气体产生
②若R的含氧酸的酸性大于Q的含氧酸的酸性,则非金属性R大于Q
③SiO2和CO2都是酸性氧化物,都能与强碱溶液反应,但不能与任何酸反应
④玻璃、水泥、水晶项链都是硅酸盐制品
⑤液态氟化氢中存在氢键,所以其分子比氯化氢更稳定
⑥氢氧化铁胶体与氯化铁溶液分别蒸干灼烧得相同的物质.
①久置于空气中的氢氧化钠溶液,加足量盐酸时有气体产生
②若R的含氧酸的酸性大于Q的含氧酸的酸性,则非金属性R大于Q
③SiO2和CO2都是酸性氧化物,都能与强碱溶液反应,但不能与任何酸反应
④玻璃、水泥、水晶项链都是硅酸盐制品
⑤液态氟化氢中存在氢键,所以其分子比氯化氢更稳定
⑥氢氧化铁胶体与氯化铁溶液分别蒸干灼烧得相同的物质.
| A、①⑥ | B、①④⑥ |
| C、②③④ | D、④⑤⑥ |
某无色溶液能与铝作用生成氢气,则溶液中可能大量共存的离子组是( )
| A、H+、Ba2+、Mg2+、NO3- |
| B、Cl-、CO32-、Cu2+、Mg2+ |
| C、NO3-、SO42-、K+、OH- |
| D、NO3-、HCO3-、Ba2+、Cl- |
一学生欲通过实验判断X,Y,Z,W四块金属的活泼性,做了如下实验并得结论:当X,Y与稀硫酸组成原电池时,Y为负极; Z可以从水中置换出H2,W不能从水中置换出H2;W能将Y从其盐溶液中置换出来,据此可知它们的活泼性顺序是( )
| A、Z>X>W>Y |
| B、Z>W>Y>X |
| C、X>Y>W>Z |
| D、X>Y>Z>W |
 X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若X原子的最外层电子是内层电子数的2倍,下列说法正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若X原子的最外层电子是内层电子数的2倍,下列说法正确的是( )| A、X的气态氢化物比Y的强 |
| B、Y的氧化物对应的水化物酸性比Z强 |
| C、W的非金属性比Z强 |
| D、X与Y形成的化合物都易溶于水 |
下列实验中,能够达到实验目的是( )
A、 实验室制取并收集氨气 |
B、 制取SO2并检验SO2的漂白性 |
C、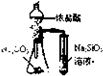 比较氯碳硅三种元素的非金属性强弱 |
D、 除去CO2中的HCl |
 纯铜在工业上主要用来制造导线、电器元件等,铜能形成+1和+2价的化合物.回答下列问题:
纯铜在工业上主要用来制造导线、电器元件等,铜能形成+1和+2价的化合物.回答下列问题: