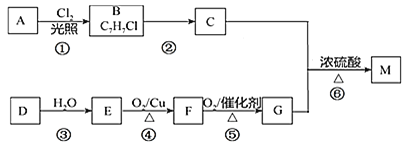
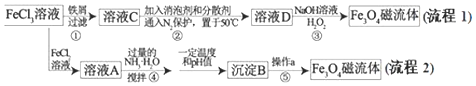
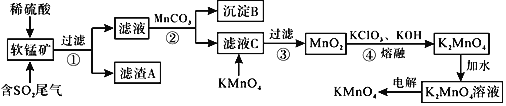
题目内容
【题目】1L某溶液A中存在![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 中的五种离子,浓度均为
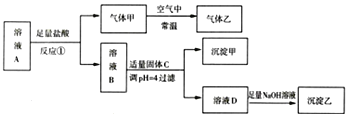
中的五种离子,浓度均为![]() 对A溶液进行以下实验,整个过程如图所示
对A溶液进行以下实验,整个过程如图所示![]() 部分产物省略
部分产物省略![]() ,反应
,反应![]() 后的溶液B与溶液A中的阴离子种类相同。下列结论正确的是
后的溶液B与溶液A中的阴离子种类相同。下列结论正确的是![]()
A.溶液B中存在的阴离子是![]() 、
、![]() 、
、![]()
B.固体C可能是MgO、![]() 或
或![]()
C.沉淀甲是![]() 、沉淀乙是
、沉淀乙是![]()
D.A中不能确定的离子是![]() 、
、![]() 和
和![]()
【答案】A
【解析】
由实验可知,向A溶液中加入足量的盐酸,有气体生成,且常温下气体甲与空气反应生成气体乙,可知甲为NO、乙为![]() ;反应
;反应![]() 后的溶液B与溶液A中的阴离子种类相同,说明反应后的溶液中的阴离子的种类没有变化,结合整个过程可知:加入盐酸而反应后的溶液中的阴离子的种类没有变化则原溶液中一定含有
后的溶液B与溶液A中的阴离子种类相同,说明反应后的溶液中的阴离子的种类没有变化,结合整个过程可知:加入盐酸而反应后的溶液中的阴离子的种类没有变化则原溶液中一定含有![]() ,一定没有
,一定没有![]() 和
和![]() ;有气体生成则含有
;有气体生成则含有![]() 和
和![]() ;一共有五种离子,且浓度均为
;一共有五种离子,且浓度均为![]() ,
,![]() 、
、![]() 、
、![]() 正好电荷守恒。说明存在的另外两种离子的带电量相同,应为
正好电荷守恒。说明存在的另外两种离子的带电量相同,应为![]() 和
和![]() ,则不含
,则不含![]() 、
、![]() 、
、![]() ,综上所述,溶液中存在的五种离子为:
,综上所述,溶液中存在的五种离子为:![]() 、
、![]() 、
、![]() 、
、![]() 和
和![]() ,以此来解答。
,以此来解答。
由上述分析可知,溶液中存在的五种离子为:![]() 、
、![]() 、
、![]() 、
、![]() 和
和![]() ,
,
A.由以上分析可知,溶液B中存在的阴离子是![]() 、
、![]() 、
、![]() ,选项A正确;
,选项A正确;
B.![]() 不能调节溶液的pH,固体C不可能是
不能调节溶液的pH,固体C不可能是![]() ,选项B错误;
,选项B错误;
C.沉淀甲是![]() ,沉淀乙是
,沉淀乙是![]() ,选项C错误;
,选项C错误;
D.由以上分析可知,一定有![]() ,没有
,没有![]() 、
、![]() ,选项D错误;
,选项D错误;
答案选A。

【题目】电离平衡常数是衡量弱电解质电离程度的物理量。
I.已知:
化学式 | 电离常数(25 ℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
(1)25 ℃时,有等浓度的NaCN溶液、Na2CO3溶液和CH3COONa溶液,三溶液的pH由大到小的顺序为________(用化学式表示)。
(2)向NaCN溶液中通入少量的CO2,发生反应的化学方程式__________________。
(3)25 ℃时,在CH3COOH与CH3COONa的混合溶液中,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)=________ mol·L-1(填精确值),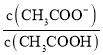 =_____。
=_____。
П.常温下有0.1 mol/L的以下几种溶液,①H2SO4溶液,②NaHSO4溶液,③CH3COOH溶液,④HCl溶液,⑤HCN溶液,⑥NH3·H2O,其中如下几种溶液的电离度(即已经电离的占原来总的百分数)如下表(已知H2SO4的第一步电离是完全的),回答下面问题:

(4)常温下,pH相同的表格中几种溶液,其物质的量浓度由大到小的顺序是(填序号,下同)________。