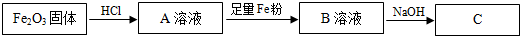题目内容
5.设NA为阿伏加德罗常数,下列说法中正确的是( )| A. | 1mol K2SO4溶于水,所得溶液中K+的数目为NA | |
| B. | 常温常压下,32g氧气所含分子的数目为NA | |
| C. | 标准状况下,22.4LH2O含有氢原子的数目为2 NA | |
| D. | 11.2L H2含有氢原子的数目为NA |
分析 A、1mol硫酸钾中含2mol钾离子;
B、分子个数N=$\frac{m}{M}{N}_{A}$;
C、标况下水为液态;
D、氢气所处的状态不明确.
解答 解:A、1mol硫酸钾中含2mol钾离子,即2NA个,故A错误;
B、分子个数N=$\frac{m}{M}{N}_{A}$=$\frac{32g}{32g/mol}$NA/mol=NA个,故B正确;
C、标况下水为液态,故不能根据气体摩尔体积来计算其物质的量,故C错误;
D、氢气所处的状态不明确,故其物质的量和原子个数无法计算,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
16.在容积不变的密闭容器中,1molN2和1molH2在一定温度下发生反应,达到平衡时,H2的转化率为30%,则平衡时的氨气的体积分数约为( )
| A. | 14% | B. | 16% | C. | 11% | D. | 20% |
13.下列有关化学反应能量变化的叙述中正确的是( )
①如果反应物的总能量低于生成物的总能量,该反应一定是吸热反应 ②只要是在点燃条件下进行的反应就一定是吸热反应 ③只要是在常温常压下进行的反应就一定是放热反应 ④燃烧反应一定是放热反应 ⑤化合反应、中和反应都是放热反应,分解反应都是吸热反应.
①如果反应物的总能量低于生成物的总能量,该反应一定是吸热反应 ②只要是在点燃条件下进行的反应就一定是吸热反应 ③只要是在常温常压下进行的反应就一定是放热反应 ④燃烧反应一定是放热反应 ⑤化合反应、中和反应都是放热反应,分解反应都是吸热反应.
| A. | ①④ | B. | ①②③ | C. | ③⑤ | D. | ④⑤ |
10.(1)补充完成F表:(请把序号①一⑦的答案对应填入答题卡上)
(2)甲元素最高价氧化物对应的水化物呈碱性(填“酸、碱”),乙元素对应的最高价氧化物的水化物的化学式为HClO4.
(3)甲与乙两元素的单质反应生成物的电子式为 .
.
(4)甲单质与丙的氢化物反应的化学方程式为2Na+2H2O═2NaOH+H2↑.
| 元素 | 甲 | 乙 | 丙 |
| 元素符号 | ① | ② | O |
| 原子结构 示意图 | 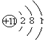 | ③ | ④ |
| 周期 | 三 | 三 | ⑤ |
| 族 | ⑥ | ⅦA | ⑦ |
(3)甲与乙两元素的单质反应生成物的电子式为
 .
.(4)甲单质与丙的氢化物反应的化学方程式为2Na+2H2O═2NaOH+H2↑.
14.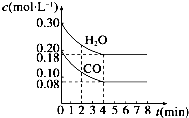 800℃时在体积为1L恒容密闭容器中,通入一定量的CO和H2O(g),发生反应:CO(g)+H2O(g)?H2(g)+CO2(g)CO和H2O(g)浓度变化如图所示.下列说法正确的是( )
800℃时在体积为1L恒容密闭容器中,通入一定量的CO和H2O(g),发生反应:CO(g)+H2O(g)?H2(g)+CO2(g)CO和H2O(g)浓度变化如图所示.下列说法正确的是( )
 800℃时在体积为1L恒容密闭容器中,通入一定量的CO和H2O(g),发生反应:CO(g)+H2O(g)?H2(g)+CO2(g)CO和H2O(g)浓度变化如图所示.下列说法正确的是( )
800℃时在体积为1L恒容密闭容器中,通入一定量的CO和H2O(g),发生反应:CO(g)+H2O(g)?H2(g)+CO2(g)CO和H2O(g)浓度变化如图所示.下列说法正确的是( )| A. | 容器中气体的压强不再改变则反应达到平衡 | |
| B. | 4 min后升高温度,CO和H2O(g)浓度也升高,则△H<0 | |
| C. | 800℃时只改变CO和H2O(g)起始投料,分别达平衡,CO的转化率与H2O(g)的转化率之和不变 | |
| D. | 若起始充入0.30mol CO、0.10mol H2O、0.20mol CO2和20mol H2,则反应将向正反应方向进行 |
15.下列有关化学用语正确的是D北京市西城外国语学校( )
| A. | 硝基苯的结构简式: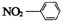 | B. | CO2分子比例模型: | ||
| C. | HClO的电子式: | D. | 中子数为10的氧原子:${\;}_{8}^{18}$O |