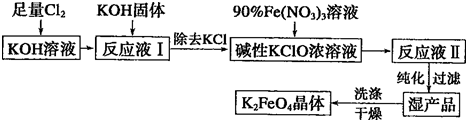
题目内容
Ⅰ.工业废水中Cr(Ⅲ)回收与再利用工艺如下:
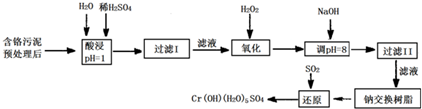
注:
①硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+、Mg2+
②部分阳离子常温下以氢氧化物形式完全沉淀时溶液的pH见下表.
(1)酸浸时,为了提高浸取率可采取的措施 (至少写一条).
(2)调pH=8是为了除去 离子(选填:Fe3+、Al3+、Ca2+、Mg2+).
(3)钠离子交换树脂的原理为:Mn++nNaR→MRn+nNa+,被交换的杂质离子是 (选填:Fe3+、Al3+、Ca2+、Mg2+).
Ⅱ.电解法处理含Cr2O72-离子的废水(pH=4~6)的一种方法是:往废水中加入适量NaCl,以铁为电极进行电解,同时鼓入空气,经过一段时间后,经过一段时间后,有Cr(OH)3和Fe(OH)3沉淀产生,使工业废水中铬含量低于排放标准.
(1)阴极电极反应式: .
(2)加入适量NaCl的作用? .
(3)鼓入空气的作用? .

注:
①硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+、Mg2+
②部分阳离子常温下以氢氧化物形式完全沉淀时溶液的pH见下表.
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
| pH | 3.7 | 9.6 | 11.1 | 8 | 9(>9溶解) |
(2)调pH=8是为了除去
(3)钠离子交换树脂的原理为:Mn++nNaR→MRn+nNa+,被交换的杂质离子是
Ⅱ.电解法处理含Cr2O72-离子的废水(pH=4~6)的一种方法是:往废水中加入适量NaCl,以铁为电极进行电解,同时鼓入空气,经过一段时间后,经过一段时间后,有Cr(OH)3和Fe(OH)3沉淀产生,使工业废水中铬含量低于排放标准.
(1)阴极电极反应式:
(2)加入适量NaCl的作用?
(3)鼓入空气的作用?
考点:物质分离和提纯的方法和基本操作综合应用,电解原理
专题:实验设计题
分析:Ⅰ、(1)酸浸时,为了提高浸取率可采取的措施是延长浸取时间、加快溶解速度等措施;硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+,酸浸是溶解物质为了提高浸取率,可以升高温度增大物质溶解度,增大接触面积增大反应速率,或加快搅拌速度等;
(2)硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+,加入NaOH溶液使溶液调节pH=8,Al3+、Fe3+转化为沉淀除去;
(3)钠离子交换树脂交换的离子是钙离子和镁离子;
Ⅱ、(1)用Fe做电极进行电解,阳极发生Fe-2e-=Fe2+,在阴极上是重铬酸根离子得电子发生还原反应,Cr2O72-发生氧化还原反应被还原为Cr3+然后生成Cr(OH)3沉淀除去;
(2)电解池中加入氯化钠NaCl可增强溶液的导电能力;
(3)通入空气Fe2+被氧化为Fe3+,最后形成沉淀而除去,以此来解答.
(2)硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+,加入NaOH溶液使溶液调节pH=8,Al3+、Fe3+转化为沉淀除去;
(3)钠离子交换树脂交换的离子是钙离子和镁离子;
Ⅱ、(1)用Fe做电极进行电解,阳极发生Fe-2e-=Fe2+,在阴极上是重铬酸根离子得电子发生还原反应,Cr2O72-发生氧化还原反应被还原为Cr3+然后生成Cr(OH)3沉淀除去;
(2)电解池中加入氯化钠NaCl可增强溶液的导电能力;
(3)通入空气Fe2+被氧化为Fe3+,最后形成沉淀而除去,以此来解答.
解答:
解:硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+,双氧水有强氧化性,能氧化还原性的物质,Fe2+和Cr3+有还原性,Fe2+和Cr3+能被双氧水氧化为高价离子,以便于与杂质离子分离;加入NaOH溶液使溶液呈碱性,Fe3+、Al3+转化为沉淀除去;最后钠离子交换树脂交换的离子是钙离子和镁离子.
I、(1)酸浸时,为了提高浸取率可采取的措施是:增加浸取时间、不断搅拌混合物、滤渣多次浸取等,
故答案为:升高温度,搅拌,过滤后再向滤渣中加入H2SO4 (多次浸取),适当延长浸取时间;
(2)硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+,加入NaOH溶液使溶液呈碱性,溶液PH=8,Fe3+、Al3+转化为沉淀除去;
故答案为:Al3+、Fe3+;
(3)钠离子交换树脂交换的离子是钙离子和镁离子,因为在此之前,Fe3+被除去,Al3+转化为偏铝酸根的形式,故答案为:Ca2+、Mg2+;
Ⅱ、(1)Fe为阳极,则阳极反应为Fe-2e-=Fe2+,溶液中重铬酸根离子在阴极放电:Cr2O72-+14H++6e-=2Cr3++7H2O,故答案为:Cr2O72-+14H++6e-=2Cr3++7H2O;
(2)因NaCl为电解质,加入适量的NaCl增强废水的导电性,便于电解的进行,故答案为:增强废水的导电性,便于电解的进行;
(3)亚铁离子具有还原性可以被空气中的氧气氧化为铁离子,所以鼓入空气,是将阳极溶解生成的Fe2+转化为Fe3+,便于形成沉淀除去,
故答案为:将阳极溶解生成的Fe2+转化为Fe3+,便于形成沉淀除去.
I、(1)酸浸时,为了提高浸取率可采取的措施是:增加浸取时间、不断搅拌混合物、滤渣多次浸取等,
故答案为:升高温度,搅拌,过滤后再向滤渣中加入H2SO4 (多次浸取),适当延长浸取时间;
(2)硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+,加入NaOH溶液使溶液呈碱性,溶液PH=8,Fe3+、Al3+转化为沉淀除去;
故答案为:Al3+、Fe3+;
(3)钠离子交换树脂交换的离子是钙离子和镁离子,因为在此之前,Fe3+被除去,Al3+转化为偏铝酸根的形式,故答案为:Ca2+、Mg2+;
Ⅱ、(1)Fe为阳极,则阳极反应为Fe-2e-=Fe2+,溶液中重铬酸根离子在阴极放电:Cr2O72-+14H++6e-=2Cr3++7H2O,故答案为:Cr2O72-+14H++6e-=2Cr3++7H2O;
(2)因NaCl为电解质,加入适量的NaCl增强废水的导电性,便于电解的进行,故答案为:增强废水的导电性,便于电解的进行;
(3)亚铁离子具有还原性可以被空气中的氧气氧化为铁离子,所以鼓入空气,是将阳极溶解生成的Fe2+转化为Fe3+,便于形成沉淀除去,
故答案为:将阳极溶解生成的Fe2+转化为Fe3+,便于形成沉淀除去.
点评:本题考查了离子方程式、化学方程式的书写、物质的分离等知识点,难度较大,注意会运用溶液的pH值对溶液中的离子进行分离,除杂的原则是:除去杂质且不引进新的杂质.

练习册系列答案
相关题目
下列烷烃化学性质中不正确是( )
| A、不能使溴水因反应褪色 |
| B、能使酸性KMnO4溶液褪色 |
| C、与Cl2发生取代反应 |
| D、可以在空气中燃烧 |
下列说法正确的是( )
| A、金属晶体具有良好的延展性,是因为金属晶体中的原子层在滑动过程中金属键未破坏 |
| B、电子云图象中黑点的疏密是指电子数的多少 |
| C、含有极性键的分子一定是极性分子 |
| D、键能越大,表示该分子越容易受热分解 |
0.01mol氯化铬(CrCl3?6H2O)在水溶液中用过量硝酸银溶液处理,产生0.02mol AgCl沉淀则此配合物可能是( )
| A、[Cr(H2O)6]Cl3 |
| B、[Cr(H2O)5Cl]Cl2 |
| C、[Cr(H2O)4Cl2]Cl |
| D、[Cr(H2O)3Cl3] |
下列物质中不能用作漂白剂的是( )
| A、SO2 |
| B、Ca(ClO)2 |
| C、浓硫酸 |
| D、Na2O2 |