题目内容
取3.40 g只含羟基,不含其他官能团的液体饱和多元醇,置于5.00 L氧气中。经点燃醇完全燃烧。反应后气体体积减少0.56 L,将气体通过CaO进行吸收,体积又减少2.80 L(所有体积均已换算成标准状况下的体积)。(1)3.4 g醇中C、H、O的物质的量分别为:
n(C)=______ mol,n(H)=______ mol,n(O)=______ mol;该醇中C、H、O原子数之比为:__________。
(2)从以上比值能否确定该醇的分子式?其原因是_______________________________。
解析:
| 答案:(1)n(C)=0.125 mol n(H)=0.300 mol
n(O)=0.100 mol C、H、O原子个数比为5∶12∶4 (3)从以上比值能确定该醇的分子式。其原因是该最简式中H原子数已饱和,所以最简式即分子式C5H12O4。
|

 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案阿斯匹林(aspirin)的有效成分是乙酰水杨酸,它是19世纪末合成成功的,作为一个有效的解热止痛、治疗感冒的药物,至今仍广泛使用,有关报道表明,人们正在发现它的某些新功能。阿斯匹林是由水杨酸(邻羟基苯甲酸)与乙酸酐进行酯化反应而得的。
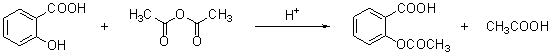
水杨酸 乙酸酐 乙酰水杨酸
(1)乙酰水杨酸的含氧官能团分别是_____________和酯基。
(2)乙酰水杨酸能在稀酸和NaOH溶液中水解。写出乙酰水杨酸与稀酸溶液共热的化学方程式:___________。
(3)写出同时符合下列四个要求的水杨酸的同分异构体: 。
①含有苯环;
②能发生银镜反应,不能发生水解反应;
③在稀NaOH溶液中,1 mol该同分异构体能与2 mol NaOH发生反应;
④只能生成两种一氯代产生。
(4)已知酚羟基遇FeC13溶液显紫色,但显色反应要在中性或弱酸性溶液进行。现要求用已有的知识检验出乙酰水杨酸分子中存在酯基。有人设计了如下的实验方案:
取一支洁净的试管,向其中加入2mL阿斯匹林清液,然后再滴入2 滴稀硫酸,将溶液在酒精灯上加热片刻后,滴入2滴FeC13溶液,振荡,无明显现象;再向其中逐滴加入Na2CO3溶液,振荡,出现了紫色。你认为逐滴加入Na2CO3溶液的目的是_____________。从此实验你得到的启示有_____________。
(5)为测定阿斯匹林中有效成分的含量,称取样品0.250 0 g ,准确加入浓度为0.1015 mol?L- NaOH溶液50.00 mL,煮沸60min。冷却后用浓度为0.1015 mol?L- 的HC1溶液返滴过量的NaOH,消耗HC1溶液记录如下:
| 数据 次数 | 1 | 2 | 3 |
| 初始读数 | 2.00 | 12.50 | 5.20 |
| 最后读数 | 27.10 | 37.40 | 33.20 |
则该产品中乙酰水杨酸的含量为(乙酰水杨酸的摩尔质量是180.16 g?mol- 。(只要求列式表示,不计算出最后结果)____________。

