题目内容
用0.1mol/L的Na2SO3溶液30mL,恰好将2×10-3 mol XO4-还原,则元素X在还原产物中的化合价是( )
分析:根据氧化还原反应中得失电子守恒计算.
解答:解:该反应中Na2SO3为还原剂,SO32-中的S被氧化,变为SO42-,化合价从+4升到+6价失电子数=0.1mol/L×0.03L×2=0.006mol,
XO4-为氧化剂,其中X元素化合价降低,开始为+7价,得失电子守恒得电子数
=3,可见X元素化合价变化为3,即从+7价降到+4价.
故选A.
XO4-为氧化剂,其中X元素化合价降低,开始为+7价,得失电子守恒得电子数
| 0.006mol |
| 0.002mol |
故选A.
点评:本题考查学生氧化还原反应中的电子守恒思想的应用知识,可以根据所学知识进行回答,难度不大.

练习册系列答案
 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案
相关题目
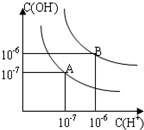 已知水在25℃和95℃时,其电离平衡曲线如图所示:
已知水在25℃和95℃时,其电离平衡曲线如图所示: