题目内容
常温下,用0.1mol/L的HCl溶液滴定a mL NaOH稀溶液,反应恰好完全时,消耗HCl溶液b mL,此时溶液中氢氧根离子的浓度c(OH-)是( )
分析:盐酸与氢氧化钠溶液恰好反应,所得溶液为NaCl溶液,氯化钠为强酸强碱盐,其溶液呈中性.
解答:解:盐酸与氢氧化钠溶液恰好反应,所得溶液为NaCl溶液,氯化钠为强酸强碱盐,其溶液呈中性,故常温下,氯化钠溶液中c(OH-)=c(H+)=1×10-7 mol/L,
故选:A.
故选:A.
点评:本题考查溶液pH值的有关计算、物质的量浓度计算,比较基础,注意反应后的溶液为中性,题目审题不细心容易计算原氢氧化钠溶液中氢氧根离子浓度.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列说法正确的是( )
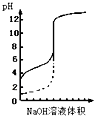

| A、△H>0的反应,常温下一定不能自发进行 | B、用0.1mol/LNaOH溶液分别滴定相同物质的量浓度和相同体积的盐酸和醋酸,其中实线表示的是滴定盐酸的曲线 | C、常温下,在0.1mol/L氨水中,加入少量NH4Cl晶体,溶液的pH减小 | D、恒容密闭容器中进行的反应3A(g)?B(g)+C(g),在其它条件不变情况下,再充入一定量的A气体,A的转化率将增大 |
 Ⅰ.研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
Ⅰ.研究NO2、SO2、CO等大气污染气体的处理具有重要意义. 常温下,用0.1mol/L NaOH溶液滴定 20.00mL 0.1 mol/L CH3COOH溶液滴定曲线如右图。下列说法正确的是
常温下,用0.1mol/L NaOH溶液滴定 20.00mL 0.1 mol/L CH3COOH溶液滴定曲线如右图。下列说法正确的是