题目内容
20.下列表述正确的是( )| A. | 体积相等的CO和N2质量一定相等 | |
| B. | 常温常压下,92g的NO2和N2O4混合气体含有的原子数为6 NA | |
| C. | 用过量NaOH溶液吸收 CO2的离子方程式:OH-+CO2=HCO3- | |
| D. | NaHSO4溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀时溶液呈中性 |
分析 A.根据阿伏加德罗定律,相同条件下的相同体积的气体的物质的量相同,根据一氧化碳和氮气的相对分子质量来分析;
B.根据NO2和N2O4的最简式均为NO2,先求出混合物中含有的NO2的物质的量,即可求出含有的氮原子的物质的量以及个数;
C.用过量NaOH溶液吸收CO2生成的是正盐;
D.假设NaHSO4为1mol,使原溶液中的SO42-恰好完全沉淀,需要Ba(OH)21mol,根据各离子的物质的量判断反应的程度,以此书写离子方程式.
解答 解:A.根据阿伏加德罗定律,相同条件下的相同体积的气体的物质的量相同,一氧化碳和氮气的相对分子质量也相同,但没有说是相同条件下,故A错误;
B.NO2和N2O4的最简式均为NO2,故混合物中含有的NO2的物质的量n=$\frac{m}{M}$=$\frac{92g}{46g/mol}=2mol$,故含有的原子的物质的量为6mol,个数为6NA个,故B正确;
C.用过量NaOH溶液吸收 CO2,生成的是正盐,反应的离子方程式为2OH-+CO2=CO32-+H2O,故C错误;
D.设NaHSO4为1mol,使原溶液中的SO42-恰好完全沉淀,需要Ba(OH)21mol,则发生反应的离子的物质的量分别为1mol,离子方程式为H++SO42-+Ba2++OH-=BaSO4↓+H2O,此时反应其实还有OH-剩余,溶液显碱性,故D错误.
故选B.
点评 本题考查离子方程式的书写,阿伏伽德罗定律的推论等知识.题目难度不大,是基础题.

练习册系列答案
相关题目
19. 25℃时,c(CH3COOH)+c(CH3COO-)=0.1mol•L-1的醋酸、醋酸钠混合溶液,c(CH3COOH)、c(CH3COO-)与pH的关系如图所示.下列叙述错误的是( )
25℃时,c(CH3COOH)+c(CH3COO-)=0.1mol•L-1的醋酸、醋酸钠混合溶液,c(CH3COOH)、c(CH3COO-)与pH的关系如图所示.下列叙述错误的是( )
 25℃时,c(CH3COOH)+c(CH3COO-)=0.1mol•L-1的醋酸、醋酸钠混合溶液,c(CH3COOH)、c(CH3COO-)与pH的关系如图所示.下列叙述错误的是( )
25℃时,c(CH3COOH)+c(CH3COO-)=0.1mol•L-1的醋酸、醋酸钠混合溶液,c(CH3COOH)、c(CH3COO-)与pH的关系如图所示.下列叙述错误的是( )| A. | 随pH增大,c(CH3COOH)与c(CH3COO-)的比值减小 | |
| B. | pH=4的溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-) | |
| C. | 25℃时,CH3COOH的电离常数K=1×10-2.75 | |
| D. | pH=5的溶液中:c(H+)+c(Na+)+c(CH3COOH)-c(OH-)=0.1 mol•L-1 |
11.根据编号①~⑩代表的元素在周期表中的位置,回答下列问题:
(1)能显+1价,还能显-1价的元素是H(填元素符号);⑦、⑧、⑨三种元素最高价氧化物对应的水化物,碱性由强到弱的顺序排列为NaOH、Mg(OH)2、Al(OH)3(填化学式).
(2)③的单质在空气中充分燃烧的化学方程式是4Li+O2$\frac{\underline{\;\;△\;\;}}{\;}$2Li2O.④与⑥形成的稳定化合物的电子式为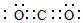 .
.
(3)①、⑤、⑥三种元素形成的一种常见盐的化学式为NH4NO3,其中含有的化学键为离子键和共价键.
(4)高温灼烧由⑦与⑩形成的化合物时,火焰呈黄色.⑧可用于航空航天合金材料的制备,工业上冶炼该单质的化学方程式为MgCl2$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | ① | ② | ||||||
| 2 | ③ | ④ | ⑤ | ⑥ | ||||
| 3 | ⑦ | ⑧ | ⑨ | ⑩ |
(2)③的单质在空气中充分燃烧的化学方程式是4Li+O2$\frac{\underline{\;\;△\;\;}}{\;}$2Li2O.④与⑥形成的稳定化合物的电子式为
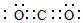 .
.(3)①、⑤、⑥三种元素形成的一种常见盐的化学式为NH4NO3,其中含有的化学键为离子键和共价键.
(4)高温灼烧由⑦与⑩形成的化合物时,火焰呈黄色.⑧可用于航空航天合金材料的制备,工业上冶炼该单质的化学方程式为MgCl2$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑.
8.能正确表示下列反应的离子方程式的是( )
| A. | 将Cl2通入氯化亚铁溶液 Fe2++Cl2═Fe3++2Cl- | |
| B. | 铜与浓硝酸的反应:Cu+4HNO3(浓)═Cu 2++2NO3-+2NO2↑+2H2O | |
| C. | 用FeCl3溶液腐蚀铜线路板:Cu+2Fe3+═Cu2++2Fe2+ | |
| D. | Ca(HCO3)2溶液与过量NaOH溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O |
15.已知卤代烃可以和钠发生反应,例如溴乙烷与钠反应为:2CH3CH2Br+2Na→CH3CH2CH2CH3+2NaBr.已知有CH3CH2Br和CH3CH2CH2CH2Br两种卤代烃,此混合物与足量的钠反应,得到的烃可能有几种( )
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
5.下列物质属于同系物的是( )
| A. |  与 与  | B. | CH3CH2Cl与CH2ClCH2CH2Cl | ||
| C. | C2H5OH与CH3OH | D. | CH3CH2CH3与CH2=CHCH3 |
12.下列有机物命名正确的是( )
| A. |  2-乙基丙烷 2-乙基丙烷 | B. | BrCH2CH2Br 二溴乙烷 | ||
| C. |  间二甲苯 间二甲苯 | D. |  2-甲基-1-丁烯 2-甲基-1-丁烯 |
10.下列属于吸热反应的是( )
| A. | 铜反应与浓硝酸 | B. | 钠与水反应 | ||
| C. | 液氨汽化 | D. | Ba(OH)2•8H2O与NH4Cl固体的反应 |