题目内容
6.某化学兴趣小组利用以下路线合成有机化合物M:
已知:R-C≡CH+R′-Br$→_{K_{2}CO_{3}}^{Pd}$R-C≡C-R′+HBr
(1)B中官能团的名称是碳碳双键和羧基,E的化学名称是苯乙炔.
(2)M的结构简式为
 ,由D生成E的反应类型是消去反应.
,由D生成E的反应类型是消去反应.(3)写出C与足量NaOH溶液在加热条件下反应的化学方程式:
 .
.(4)2分子A在一定条件下反应生成一种含有3个六元环的化合物,该生成物的结构简式为
 .
.(5)同时满足下列条件的A的同分异构体有17种(不考虑立体异构).
①属于芳香族化合物;
②能与碳酸氢钠溶液反应生成CO2;
③在一定条件下能发生催化氧化,且其产物能发生银镜反应.
(6)以乙烯为起始原料,选用必要的无机试剂可以合成3-己炔,写出合成路线(用结构简式表示有机物),用箭头表示转化关系,箭头上注明试剂和反应条件).
分析 A在加热、浓硫酸作催化剂条件下发生反应生成B,B能和溴发生加成反应生成C,根据C结构简式知,B为 ,A发生消去反应生成B,2分子A在一定条件下反应生成一种含有3个六元环的化合物,则A结构简式为
,A发生消去反应生成B,2分子A在一定条件下反应生成一种含有3个六元环的化合物,则A结构简式为 ,D和NaOH的醇溶液发生消去反应生成E,E结构简式为
,D和NaOH的醇溶液发生消去反应生成E,E结构简式为 ,E发生信息中的反应生成M,M结构简式为
,E发生信息中的反应生成M,M结构简式为 ,
,
(6)CH2=CH2和溴发生加成反应生成CH2BrCH2Br,CH2BrCH2Br和NaOH的醇溶液在加热条件下发生消去反应生成CH≡CH,CH2=CH2和HBr发生加成反应生成CH3CH2Br,CH≡CH和CH3CH2Br在Pd、K2CO3条件下发生取代反应生成CH3CH2C≡CCH2CH3,结合题目分析解答.
解答 解:A在加热、浓硫酸作催化剂条件下发生反应生成B,B能和溴发生加成反应生成C,根据C结构简式知,B为 ,A发生消去反应生成B,2分子A在一定条件下反应生成一种含有3个六元环的化合物,则A结构简式为
,A发生消去反应生成B,2分子A在一定条件下反应生成一种含有3个六元环的化合物,则A结构简式为 ,D和NaOH的醇溶液发生消去反应生成E,E结构简式为
,D和NaOH的醇溶液发生消去反应生成E,E结构简式为 ,E发生信息中的反应生成M,M结构简式为
,E发生信息中的反应生成M,M结构简式为 ,
,
(1)B为 ,B中官能团名称是碳碳双键和羧基,E结构简式为
,B中官能团名称是碳碳双键和羧基,E结构简式为 ,其名称是苯乙炔,
,其名称是苯乙炔,
故答案为:碳碳双键和羧基;苯乙炔;
(2)M的结构简式为 ,由D生成E的反应类型是消去反应,
,由D生成E的反应类型是消去反应,
故答案为: ;消去反应;
;消去反应;
(3)C中含有羧基,能和NaOH发生中和反应,含有-Br,能和氢氧化钠溶液发生水解反应,C与足量NaOH溶液在加热条件下反应的化学方程式: ,
,
故答案为: ;
;
(4)A结构简式为 ,A中含有醇羟基和羧基,所以在一定条件下能发生酯化反应,2分子A在一定条件下反应生成一种含有3个六元环的化合物,该生成物的结构简式为
,A中含有醇羟基和羧基,所以在一定条件下能发生酯化反应,2分子A在一定条件下反应生成一种含有3个六元环的化合物,该生成物的结构简式为 ,故答案为:
,故答案为: ;
;
(5)A为 ,A的同分异构体符合下列条件(不考虑立体异构),
,A的同分异构体符合下列条件(不考虑立体异构),
①属于芳香族化合物,说明含有苯环;
②能与碳酸氢钠溶液反应生成CO2,说明含有-COOH;
③在一定条件下能发生催化氧化,且其产物能发生银镜反应,说明羟基位于边上,
如果取代基为-COOH和-CH2CH2OH,有邻间对3种结构;
如果取代基为-CH2COOH和-CH2OH,有邻间对3种结构;
如果取代基为-CH3、-CH2OH、-COOH,如果-CH3、-CH2OH处于邻位,有4种结构;如果-CH3、-CH2OH处于间位,有4种结构;如果-CH3、-CH2OH处于对位,有2种结构;
如果取代基为-CH(COOH)CH2OH,有1种结构,
所以符合条件的同分异构体有17种,
故答案为:17;
(6)CH2=CH2和溴发生加成反应生成CH2BrCH2Br,CH2BrCH2Br和NaOH的醇溶液在加热条件下发生消去反应生成CH≡CH,CH2=CH2和HBr发生加成反应生成CH3CH2Br,CH≡CH和CH3CH2Br在Pd、K2CO3条件下发生取代反应生成CH3CH2C≡CCH2CH3,
其合成路线为 ,
,
答:合成流程为 .
.
点评 本题考查有机物推断和合成,为高考高频点,涉及物质推断、物质合成、同分异构体种类判断、反应类型判断等知识点,明确有机物中各物质之间的转化及转化条件是解本题关键,难点是同分异构体种类判断,易漏掉-COOH和-CH2OH位于同一个碳原子上的情况,题目难度中等.

| A. | 人类目前所直接利用的能量大部分是由化学反应产生的 | |
| B. | 化学反应一定伴随着能量变化 | |
| C. | 人体运动所消耗的能量与化学反应无关 | |
| D. | 植物的光合作用将太阳能转化为化学能 |
| 元素符号 | 元素性质与原子(或分子)结构 |
| T | 最外层电子数是次外层电子数的3倍 |
| X | 常温下单质为双原子分子,分子中含有3对共用电子对 |
| Y | M层比K层少1个电子 |
| Z | 第3周期元素的简单离子中半径最小 |

(2)元素Y与元素Z相比,金属性较强的是Na(用元素符号表示),下列表述中能证明这一事实的是CD(填序号).
A、Y单质的熔点比Z单质低B、Y的化合价比Z低
C、Y单质与水反应比Z单质剧烈 D、Y的最高价氧化物的水化物的碱性比Z强
(3)T、X、Y、Z中有两种元素能形成既有离子键又有非极性键的化合物,写出该化合物的化学式Na2O2
(4)元素T和氢元素以原子个数比1:1化合物形成的化合物的电子式
 .
.  能源与材料、信息被称为现代社会发展的三大支柱,化学与能源有着密切联系.
能源与材料、信息被称为现代社会发展的三大支柱,化学与能源有着密切联系.(1)下表中的数据表示破坏1mol化学键需消耗的能量(即键能,单位为kJ•mol-1):
| 化学键 | H-H | Cl-Cl | H-Cl |
| 键能 | 436 | 243 | 431 |
(2)天然气是一种重要的清洁能源和化工原料,其主要成分为甲烷.
①以甲烷、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池.该电池的负极反应式为CH4-8e-+10OH-=CO32-+7H2O.
②将质量相等的铁棒和石墨棒分别插入CuCl2溶液中,铁棒接甲烷燃料电池负极,石墨棒接该电池正极,一段时间后测得铁棒比石墨棒增加了6.4克.写出铁棒电极上发生的电极反应式Cu2++2e-═Cu; 则理论上消耗CH4的体积在标准状况下为0.56L.
(3)如图所示的实验装置中,丙为用碘化钾溶液润湿的滤纸,m、n为夹在滤纸两端的铂夹;丁为直流电源,x、y为电源的两极;G为电流计;A、B、C、D四个电极均为石墨电极.若在两试管中充满H2SO4溶液后倒立于H2SO4溶液的水槽中,闭合K2,断开K1.
①丙电解时反应的离子方程式为2I-+2H2O $\frac{\underline{\;通电\;}}{\;}$I2+H2↑+2OH-.
②继续电解一段时间后,甲池中A、B极均部分被气体包围,此时断开K2,闭合K1,电流计G指针发生偏转,则B极的电极反应式为O2+4e-+4H+=2H2O,C极的电极反应为4OH-+4e-=O2↑+2H2O.
 +nCH2═
+nCH2═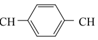 ═CH2$\stackrel{催化剂}{→}$
═CH2$\stackrel{催化剂}{→}$ +(2n-1)HI
+(2n-1)HI下列说法正确的是( )
| A. | 合成PPV的反应为加聚反应 | |
| B. | PPV与聚苯乙烯具有相同的重复结构单元 | |
| C. |  和苯乙烯互为同系物 和苯乙烯互为同系物 | |
| D. | 通过质谱法测定PPV的平均相对分子质量,可得其聚合度 |
 消除氮氧化物、二氧化硫等物质造成的污染是目前研究的重要课题.
消除氮氧化物、二氧化硫等物质造成的污染是目前研究的重要课题.