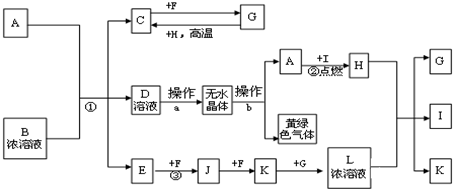
题目内容
下列实验操作正确的是( )
| A、可用托盘天平和称量纸称取10.2g NaOH |
| B、某实验需要900ml 0.1mol/L的硫酸铜溶液,则配制该溶液需称取22.5g胆矾晶体 |
| C、用10 mL量筒量取5.2 mL硫酸,仰视时实际量得的液体体积大于5.2 mL |
| D、焰色反应实验中,连续做两个样品时,应将铂丝用硫酸洗净并灼烧到无特殊焰色 |
考点:化学实验方案的评价
专题:
分析:A.NaOH易潮解,具有腐蚀性;
B.需要900ml 0.1mol/L的硫酸铜溶液,应选1000mL容量瓶配制,结合m=cVM计算;
C.量筒小刻度在下方,仰视时,硫酸凹液面的最低点在5.2mL上方;
D.硫酸不挥发,干扰实验.
B.需要900ml 0.1mol/L的硫酸铜溶液,应选1000mL容量瓶配制,结合m=cVM计算;
C.量筒小刻度在下方,仰视时,硫酸凹液面的最低点在5.2mL上方;
D.硫酸不挥发,干扰实验.
解答:
解:A.NaOH易潮解,具有腐蚀性,应选择托盘天平和小烧杯称取10.2g NaOH,故A错误;
B.需要900ml 0.1mol/L的硫酸铜溶液,应选1000mL容量瓶配制,则胆矾晶体的质量为m=cVM=1L×0.1mol/L×250g/mol=25.0g,故B错误
C.量筒小刻度在下方,仰视时,硫酸凹液面的最低点在5.2mL上方,则仰视时实际量得的液体体积大于5.2 mL,故C正确;
D.硫酸不挥发,干扰实验,则焰色反应实验中,连续做两个样品时,应将铂丝用稀盐酸洗净并灼烧到无特殊焰色,故D错误;
故选C.
B.需要900ml 0.1mol/L的硫酸铜溶液,应选1000mL容量瓶配制,则胆矾晶体的质量为m=cVM=1L×0.1mol/L×250g/mol=25.0g,故B错误
C.量筒小刻度在下方,仰视时,硫酸凹液面的最低点在5.2mL上方,则仰视时实际量得的液体体积大于5.2 mL,故C正确;
D.硫酸不挥发,干扰实验,则焰色反应实验中,连续做两个样品时,应将铂丝用稀盐酸洗净并灼烧到无特殊焰色,故D错误;
故选C.
点评:本题考查化学实验方案的评价,为高频考点,把握称量、溶液配制、焰色反应及实验操作为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
相关题目
保健医生提示:胃酸过多的人,不宜多吃苹果,因为苹果汁的pH( )
| A、大于7 | B、等于7 |
| C、小于7 | D、不确定 |
将一定量有机物充分燃烧后的产物通入足量石灰水中完全吸收,经过滤得到20g白色沉淀,滤液质量比原石灰水减少5.8g,该有机物是( )
| A、甲烷 | B、乙烯 |
| C、乙醇 | D、甲酸甲酯 |
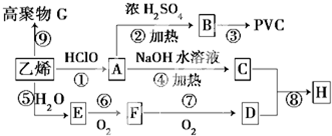
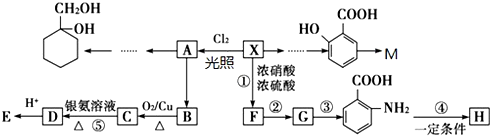
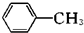
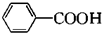
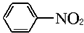
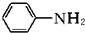 (苯胺,易被氧化)
(苯胺,易被氧化)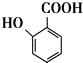 生成高分子化合物M的化学方程式:
生成高分子化合物M的化学方程式: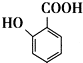 有多种同分异构体,其中含有1个醛基和1个羟基的芳香族化合物有
有多种同分异构体,其中含有1个醛基和1个羟基的芳香族化合物有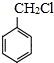 和其他无机化合物合成
和其他无机化合物合成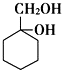 最合理步骤的反应类型依次是:
最合理步骤的反应类型依次是: