题目内容
某化学兴趣小组需要1mol﹒L-1的稀硫酸200ml与锌反应来制备氢气,而实验室只有10mol﹒L-1硫酸,需要用量筒量取多少ml该硫酸?至少需要含锌80%的粗锌多少克?制备的氢气用500ml的集气瓶收集需要几个?(已知该条件下气体摩尔体积为23L﹒mol -1,生成的氢气全部收集)
考点:化学方程式的有关计算
专题:计算题
分析:根据稀释定律计算需要浓硫酸的体积;
发生反应:Zn+H2SO4=ZnSO4+H2↑,利用方程式计算参加反应的Zn的物质的量、生成氢气物质的量,再根据m=nM计算Zn的质量,进而计算需要粗锌的质量,根据V=nVm计算氢气体积,进而计算需要集气瓶数目.
发生反应:Zn+H2SO4=ZnSO4+H2↑,利用方程式计算参加反应的Zn的物质的量、生成氢气物质的量,再根据m=nM计算Zn的质量,进而计算需要粗锌的质量,根据V=nVm计算氢气体积,进而计算需要集气瓶数目.
解答:
解:设需要10mol﹒L-1硫酸xmL,由稀释定律可知:
200mL×1mol/L=xmL×10mol/L
解得x=20.0
硫酸物质的量为0.2L×1mol/L=0.2mol,
令参加反应的Zn的物质的量为x,生成氢气为y,则:
Zn+H2SO4=ZnSO4+H2↑
1 1 1
x 0.2mol y
x=
=0.2mol
y=
=0.2mol
故参加反应的Zn的质量为0.2mol×65g/mol=13g,则粗锌质量为13g÷80%=16.25g;
生成氢气体积为0.2mol×23L/mol=4.6L=4600mL,由于
=9.2,故需要10个集气瓶,
答:需要浓硫酸体积为20.0mL;消耗粗锌质量为16.25g;需要10故集气瓶收集氢气.
200mL×1mol/L=xmL×10mol/L
解得x=20.0
硫酸物质的量为0.2L×1mol/L=0.2mol,
令参加反应的Zn的物质的量为x,生成氢气为y,则:
Zn+H2SO4=ZnSO4+H2↑
1 1 1
x 0.2mol y
x=
| 0.2mol×1 |
| 1 |
y=
| 0.2mol×1 |
| 1 |
故参加反应的Zn的质量为0.2mol×65g/mol=13g,则粗锌质量为13g÷80%=16.25g;
生成氢气体积为0.2mol×23L/mol=4.6L=4600mL,由于
| 4480mL |
| 500mL |
答:需要浓硫酸体积为20.0mL;消耗粗锌质量为16.25g;需要10故集气瓶收集氢气.
点评:本题考查溶液配制、化学方程式计算等,难度不大,侧重对基础知识的巩固.

练习册系列答案
相关题目
某原电池装置如图所示,盐桥中装有用饱和氯化钾溶液浸泡过的琼脂.下列叙述正确的是( )
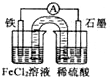

| A、原电池工作一段时间后,FeCl2溶液中c(Cl-)会增大 |
| B、此电池工作原理与硅太阳能电池工作原理相同 |
| C、Fe为正极,石墨上发生的反应为:2H++2e-═H2↑ |
| D、若装置中的盐桥用铁丝代替,电流表指针无偏转 |
物质的性质决定物质的用途.下列因果关系不成立的是( )
| A、因为红磷燃烧能产生大量白烟,所以可用于制作烟幕弹 |
| B、因为铜的化学性质不活泼,所以可镀在某些铁制品表面防止铁生锈 |
| C、因为氮气的化学性质不活泼,所以常用于食品包装袋内防变质 |
| D、因为CO有可燃性,所以常用于冶炼金属 |
常温时向某溶液中滴入石蕊试液,溶液呈蓝色,其中可能大量共存的离子是( )
| A、Fe3+、Na+、Cl-、SO42- |
| B、S2-、Na+、Cl-、ClO- |
| C、Al3+、K+、SO32-、S2- |
| D、Ag(NH3)2+、K+、Cl-、OH- |
为了防止钢铁锈蚀,下列防护方法中正确的是( )
| A、在精密机床的铁床上安装铜螺钉 |
| B、在排放海水的钢铁阀门上用导线连接一块石墨,一同浸入海水中 |
| C、在海轮舷上用铁丝系住锌板浸在海水里 |
| D、在地下输油的铸铁管上接直流电源的正极 |
硫酸镁和硫酸铝溶液等体积混合后,铝离子浓度为0.2mol?L-1,硫酸根离子的浓度为0.4mol?L-1,则混合液中镁离子的浓度为( )
| A、0.1mol?L-1 |
| B、0.15mol?L-1 |
| C、0.2mol?L-1 |
| D、0.3mol?L-1 |
下列对化学知识概括合理的是( )
| A、酸性氧化物都是非金属氧化物 |
| B、一种元素可能有多种氧化物,但同种化合价只对应一种氧化物 |
| C、丁达尔效应可用于区别溶液与胶体,云、雾均能产生丁达尔效应 |
| D、熔融状态能导电的物质一定是离子化合物 |
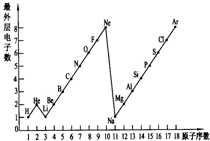 图表是整理数据、发现其中规律的一种重要工具.1~18号元素原子最外层电子数与原子序数的关系如图.试回答:
图表是整理数据、发现其中规律的一种重要工具.1~18号元素原子最外层电子数与原子序数的关系如图.试回答: