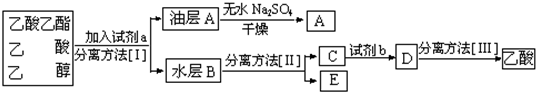
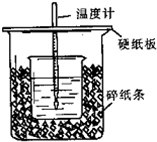
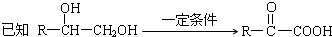
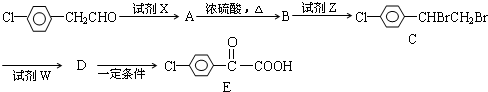
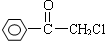题目内容
A、B、C、D均为可溶于水的固体,组成它们的离子有:
分别取他们的水溶液进行实验,结果如下
①B溶液与适量的Ba(OH)2溶液反应生成白色沉淀,加入过量Ba(OH)2溶液沉淀量减少但不消失;
②在呈黄色的A溶液中滴加硝酸银溶液,无明显现象;
③向D溶液中加入KSCN溶液,溶液不会呈红色,再滴加氯水,溶液呈红色.
(1)据此推断它们是:A ;B ;C D .
(2)证明D溶液中所含金属阳离子的方法和现象是 .
| 阳离子 | Na+、Fe2+、Fe3+、Al3+ |
| 阴离子 | OH-、Cl-、NO3-、SO42- |
①B溶液与适量的Ba(OH)2溶液反应生成白色沉淀,加入过量Ba(OH)2溶液沉淀量减少但不消失;
②在呈黄色的A溶液中滴加硝酸银溶液,无明显现象;
③向D溶液中加入KSCN溶液,溶液不会呈红色,再滴加氯水,溶液呈红色.
(1)据此推断它们是:A
(2)证明D溶液中所含金属阳离子的方法和现象是
考点:无机物的推断
专题:
分析:A、B、C、D均为可溶于水的固体,则OH-离子只能结合Na+,
①B溶液与适量的Ba(OH)2溶液反应生成白色沉淀,加入过量Ba(OH)2溶液沉淀量减少但不消失,溶解的沉淀为氢氧化铝,则B中含有Al3+,不溶解的沉淀应该为硫酸钡,则B中还应该含有SO42-,所以B为硫酸铝;
②在呈黄色的A溶液中滴加硝酸银溶液,无明显现象,A溶液为黄色,则A中含有Fe3+,A溶液中滴加硝酸银溶液没有生成氯化银沉淀,则A中不含Cl-,则A只能为硝酸铁;
③向D溶液中加入KSCN溶液,溶液不会呈红色,再滴加氯水,溶液呈红色,说明D中含有亚铁离子,则D为氯化亚铁,
根据以上分析进行解答.
①B溶液与适量的Ba(OH)2溶液反应生成白色沉淀,加入过量Ba(OH)2溶液沉淀量减少但不消失,溶解的沉淀为氢氧化铝,则B中含有Al3+,不溶解的沉淀应该为硫酸钡,则B中还应该含有SO42-,所以B为硫酸铝;
②在呈黄色的A溶液中滴加硝酸银溶液,无明显现象,A溶液为黄色,则A中含有Fe3+,A溶液中滴加硝酸银溶液没有生成氯化银沉淀,则A中不含Cl-,则A只能为硝酸铁;
③向D溶液中加入KSCN溶液,溶液不会呈红色,再滴加氯水,溶液呈红色,说明D中含有亚铁离子,则D为氯化亚铁,
根据以上分析进行解答.
解答:
解:A、B、C、D均为可溶于水的固体,则OH-离子只能结合Na+,即四种物质中有一种为NaOH,
根据①可知,溶解的沉淀为氢氧化铝,则B中含有Al3+,不溶解的沉淀应该为硫酸钡,则B中还应该含有SO42-,所以B为Al2(SO4)3;
②在呈黄色的A溶液中滴加硝酸银溶液,无明显现象,根据A溶液为黄色可知,则A中含有Fe3+,又A溶液中滴加硝酸银溶液没有生成AgCl沉淀,则A中不含Cl-,所以A为Fe(NO3)3;
③向D溶液中加入KSCN溶液,溶液不会呈红色,再滴加氯水,溶液呈红色,说明D中含有Fe2+离子,则D为FeCl2,则氢氧化钠为C,
(1)根据以上分析可知,A为Fe(NO3)3、B为Al2(SO4)3、C为NaOH、D为FeCl2,
故答案为:Fe(NO3)3;Al2(SO4)3;NaOH;
(2)D为氯化亚铁,金属阳离子为亚铁离子,检验亚铁离子的方法和现象为:向溶液中加入KSCN溶液,溶液不会呈红色,再滴加氯水,溶液呈红色,证明溶液中含有亚铁离子,
故答案为:向FeCl2溶液中加入KSCN溶液,溶液不会呈红色,再滴加氯水,溶液呈红色.
根据①可知,溶解的沉淀为氢氧化铝,则B中含有Al3+,不溶解的沉淀应该为硫酸钡,则B中还应该含有SO42-,所以B为Al2(SO4)3;
②在呈黄色的A溶液中滴加硝酸银溶液,无明显现象,根据A溶液为黄色可知,则A中含有Fe3+,又A溶液中滴加硝酸银溶液没有生成AgCl沉淀,则A中不含Cl-,所以A为Fe(NO3)3;
③向D溶液中加入KSCN溶液,溶液不会呈红色,再滴加氯水,溶液呈红色,说明D中含有Fe2+离子,则D为FeCl2,则氢氧化钠为C,
(1)根据以上分析可知,A为Fe(NO3)3、B为Al2(SO4)3、C为NaOH、D为FeCl2,
故答案为:Fe(NO3)3;Al2(SO4)3;NaOH;
(2)D为氯化亚铁,金属阳离子为亚铁离子,检验亚铁离子的方法和现象为:向溶液中加入KSCN溶液,溶液不会呈红色,再滴加氯水,溶液呈红色,证明溶液中含有亚铁离子,
故答案为:向FeCl2溶液中加入KSCN溶液,溶液不会呈红色,再滴加氯水,溶液呈红色.
点评:本题考查了无机推断,侧重考查离子性质、离子反应发生条件及离子共存知识,题目难度中等,明确常见离子的性质及检验方法为解答关键,试题有利于提高学生的分析、理解能力及灵活应用所学知识解决实际问题的能力.

练习册系列答案
相关题目
实验室制取下列气体时,必须用排水法收集的是( )
| A、NO |
| B、SO2 |
| C、NH3 |
| D、Cl2 |
下列方法中,不能用于实验室制备氨气的是( )
| A、加热浓氨水 |
| B、将浓氨水滴到生石灰上 |
| C、加热氯化铵固体 |
| D、将熟石灰和氯化铵的混合物加热 |
下列说法错误的是( )
| A、已知2NO2?N2O4加压后颜色先变深后变浅 |
| B、在密闭容中发生下列反应aA(g)?cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.6倍,故可知A的转化率变小 |
| C、在密闭容器中进行如下反应:X2(g)+Y2(g)?2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,Z的浓度有可能是0.4 mol/L |
| D、未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生.下列属于未来新能源标准的是⑤⑥⑦⑧. ①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥生物质能 ⑦风能 ⑧氢能 |
FeCl3、CuCl2的混合溶液中加入铁粉,充分反应后仍有固体存在,则下列判断不正确的是( )
| A、加入KSCN溶液一定不变红色 |
| B、溶液中一定含Fe2+ |
| C、溶液中一定不含Cu2+ |
| D、剩余固体中一定含Cu |