题目内容
4.利用反应“Cu+2Ag+═2Ag+Cu2+”可以设计一个化学电池,若正极材料用石墨碳棒,则该电池的负极材料是Cu,电解质溶液是AgNO3溶液.原电池工作一段时间后,若导线上通过2mol电子,则正极会增重216g.分析 氧化还原反应中,失电子的极是负极,电解质溶液根据氧化还原反应来确定,根据正极发生反应2Ag++2e-=2Ag,进行计算求解.
解答 解:自发的氧化还原反应Cu+2Ag+=2Ag+Cu2+中,Cu失电子,做负极,可溶性的银盐即AgNO3溶液作电解质,正极发生反应2Ag++2e-=2Ag,导线上通过2mol电子,所以生成2mol的银,质量为216g,
故答案为:Cu;AgNO3溶液;216.
点评 本题考查学生原电池的工作原理知识,可以根据所学知识进行回答,注意根据电极反应式计算电极上增加的质量,难度不大.

练习册系列答案
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案
相关题目
15.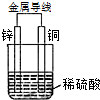 图是以Zn和Cu为电极,稀H2SO4为电解质溶液形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下:
图是以Zn和Cu为电极,稀H2SO4为电解质溶液形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下:
(1)在卡片上,叙述合理的是③⑤(填序号).
(2)在实验中,甲同学发现不仅在铜片上有气泡产生,而且在锌片上也产生了气体,分析原因可能是锌片不纯,在锌片上形成原电池.
(3)如果把锌片换成石墨,发现电流计指针几乎不能偏转,原因Cu和石墨都不与硫酸反应,不会形成原电池.
(4)如果把硫酸换成硫酸铜溶液,猜测铜极(填“锌极”或“铜极”)变粗,原因是Cu2++2e-=Cu(用电极方程式表示).
 图是以Zn和Cu为电极,稀H2SO4为电解质溶液形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下:
图是以Zn和Cu为电极,稀H2SO4为电解质溶液形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下:| Date:2015.03.06 实验后的记录: ①Zn为阳极,Cu为阴极 ②H+向负极移动 ③电子流动方向Zn→Cu ④Zn极有H2产生 ⑤若有1mol电子流过导线,则产生H2为0.5mol. ⑥正极的电极反应式:Zn-2e-=Zn2+ |
(2)在实验中,甲同学发现不仅在铜片上有气泡产生,而且在锌片上也产生了气体,分析原因可能是锌片不纯,在锌片上形成原电池.
(3)如果把锌片换成石墨,发现电流计指针几乎不能偏转,原因Cu和石墨都不与硫酸反应,不会形成原电池.
(4)如果把硫酸换成硫酸铜溶液,猜测铜极(填“锌极”或“铜极”)变粗,原因是Cu2++2e-=Cu(用电极方程式表示).
19. 如图所示是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录如下,这些记录中合理的是( )
如图所示是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录如下,这些记录中合理的是( )
 如图所示是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录如下,这些记录中合理的是( )
如图所示是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录如下,这些记录中合理的是( )| A. | 铜是负极,锌为正极 | |
| B. | 铜表面产生大量气体 | |
| C. | 正极反应式:Cu-2e-═Cu2+,发生氧化反应 | |
| D. | 导线中电子的流向是:Cu→Zn |
9.下列曲线图的描述正确的是( )
| A. | 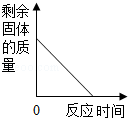 加热一定量高锰酸钾固体制取氧气 | |
| B. | 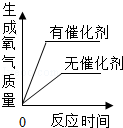 用一定量的双氧水制取氧气 | |
| C. | 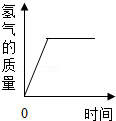 一定质量的锌粒与足量稀盐酸反应 | |
| D. | 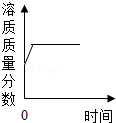 在恒温条件下往硝酸钾饱和溶液中继续加入硝酸钾固体 |
16.将甲烷和氯气混合后,在光照条件下按如图装置进行实验,下列说法中正确的是( )

| A. | 此反应属于加成反应 | B. | 此反应无光照也可发生 | ||
| C. | 用此方法可制备纯净的CH3Cl | D. | 一段时间后试管内壁出现油状液滴 |
13.下列有机物的表达式不正确的是( )
| A. | 乙烯(C2H4)的电子式: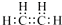 | B. | 丙烯(C3H6)的结构简式:CH2CHCH3 | ||
| C. | 立方烷(C8H8)的键线式: | D. | 溴乙烷(C2H5Br)的比例模型: |
14.将下列各种液体分别与溴水混合并振荡,静置后混合液分为两层,溴水层几乎无色的是( )
| A. | 苯 | B. | 酒精 | C. | 碘化钾溶液 | D. | 己烷 |
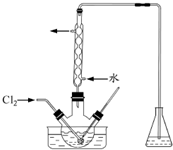 实验室从含碘废液(除H2O外,含有CCl4、I2、I-等)中回收碘,其实验过程如下:
实验室从含碘废液(除H2O外,含有CCl4、I2、I-等)中回收碘,其实验过程如下: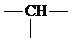 .则它的可能结构有( )
.则它的可能结构有( )