题目内容
11. 冬青油又叫水杨酸甲酯,是一种重要的有机合成原料.某化学小组用水杨酸(
冬青油又叫水杨酸甲酯,是一种重要的有机合成原料.某化学小组用水杨酸(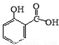 )和甲醇在酸性催化剂催化下合成水杨酸甲酯并计算其产率.
)和甲醇在酸性催化剂催化下合成水杨酸甲酯并计算其产率.实验步骤:
Ⅰ.如图,在三颈烧瓶中加入13.8g (0.1mol)水杨酸和24g(30mL,0.75mol)甲醇,向混合物中加入约10mL甲苯(甲苯与水形成的共沸物,沸点为85℃,该实验中加入甲苯,易将水蒸出),再小心地加入5mL浓硫酸,摇动混匀,加入1~2粒沸石,组装好实验装置,在85~95℃下恒温加热反应1.5小时:
Ⅱ.待装置冷却后,分离出甲醇,然后转移至分液漏斗,依次用少量水、5%NaHCO3溶液和水洗涤;分出的产物加入少量无水MgSO4固体,过滤得到粗酯;
Ⅲ.将粗酯进行蒸馏,收集221℃~224℃的馏分,得水杨酸甲酯9.12g.
常用物理常数:
| 名称 | 分子量 | 颜色状态 | 相对密度 | 熔点(℃) | 沸点(℃) |
| 水杨酸甲酯 | 152 | 无色液体 | 1.18 | -8.6 | 224 |
| 水杨酸 | 138 | 白色晶体 | 1.44 | 158 | 210 |
| 甲醇 | 32 | 无色液体 | 0.792 | -97 | 64.7 |
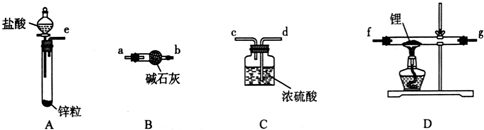
(1)仪器A的名称是球形冷凝管,加入沸石的作用是防止暴沸.若加热后发现未加沸石,应采取的正确方法是停止加热,待冷却后加入.
(2)制备水杨酸甲酯时,最合适的加热方法是水浴加热.
(3)实验中加入甲苯对合成水杨酸甲酯的作用是加入甲苯易将水蒸出,使平衡向右移动,从而提高反应的产率.
(4)反应结束后,分离出甲醇采用的方法是蒸馏(或水洗分液).
(5)实验中加入无水硫酸镁的作用是除水或干燥.本实验的产率为60% (保留两位有效数字).
分析 (1)根据题中仪器A的构造判断该仪器的名称;给液体加热加入沸石可以防止瀑沸,若加热后发现未加沸石,应冷却后补加;
(2)制备水杨酸甲酯时控制温度在85~95℃下恒温下加热反应,需要温度计控制水浴温度加热;
(3)根据题意可知“该实验中加入甲苯,易将水蒸出”,水在低温下挥发,同时减少了甲醇的消耗;
(4)根据物质的溶解性来解答;
(5)MgSO4固体吸收粗酯中有水分;先根据水杨酸和甲醇的物质的量,然后判断过量情况,根据不足量计算出理论上生成水杨酸甲酯的物质的量,最后根据实际上制取的水杨酸甲酯计算出产率;
解答 解:(1)由装置中仪器A的构造可知,仪器A的名称是球形冷凝管,使挥发出来的气体冷凝回流;给液体加热加入沸石可以防止瀑沸,若加热后发现未加沸石,应冷却后补加,
故答案为:球形冷凝管;防止暴沸;停止加热,待冷却后加入;
(2)控制温度在85~95℃下恒温下加热反应,温度低于100℃,应采取水浴加热;
故答案为:水浴加热;
(3)该实验中加入甲苯,易将水蒸出,反应产生的水从反应体系中分离开来,使得平衡向右移动,水在低温下挥发,同时减少了甲醇的消耗,从而提高反应的产率;
故答案为:加入甲苯易将水蒸出,使平衡向右移动,从而提高反应的产率;
(4)甲醇和水杨酸甲酯是互溶的液体,可用蒸馏来分离;甲醇易溶于水,水杨酸甲酯不溶于水,可以水洗来分离,
故答案为:蒸馏(或水洗分液);
(5)MgSO4固体吸收粗酯中有水分,所以验中加入无水硫酸镁的作用是除水或干燥,水杨酸和甲醇的物质的量分别为:0.1mol,0.75mol,由于水杨酸和甲醇是按照1:1进行反应,所以甲醇过量,生成水杨酸甲酯的量要按照水杨酸的物质的量计算,即理论上生成0.1mol水杨酸甲酯;实际上生成的水杨酸甲酯的质量为9.12g,物质的量为:$\frac{9.12g}{152g/mol}$=0.06mol,所以实验中水杨酸甲酯的产率$\frac{0.06mol}{0.1mol}$×100%=60%;
故答案为:除水或干燥;60%.
点评 本题以物质的制备为背景,考查了常见仪器的构造与安装、混合物的分离、提纯、物质的制取、物质产率的计算等知识,题目难度较大,试题涉及的题量较大,知识点较多,充分培养了学生的分析、理解能力及灵活应用所学知识的能力.

 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案| A. | 硝酸钾 | B. | 醋酸钠 | C. | 硫酸氢钠 | D. | 硫酸铜 |
(一)制备苯甲酸乙酯
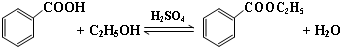
| 沸点(℃) | 密度(g•cm-3) | |
| 苯甲酸 | 249 | 1.2659 |
| 苯甲酸乙酯 | 212.6 | 1.05 |
| 乙醇 | 78.5 | 0.7893 |
| 环己烷 | 80.8 | 0.7785 |
| 乙醚 | 34.51 | 0.7318 |
| 环己烷、乙醇和水共沸物 | 62.1 |

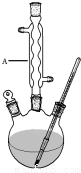
(1)制备苯甲酸乙酯,装置最合适的是图2中的B

反应液中的环己烷在本实验中的作用(通过形成水-乙醇-环己烷三元共沸物)带出生成的水,促进酯化反应向正向进行.
(2)步骤②控制温度在65~70℃缓慢加热液体回流,分水器中逐渐出现上、下两层液体,直到反应完成,停止加热.放出分水器中的下层液体后,继续加热,蒸出多余的乙醇和环己烷.反应完成的标志是分水器中下层(水层)液面不再升高.
(3)步骤③碳酸钠的作用是中和苯甲酸和硫酸.
(4)步骤④将中和后的液体转入分液漏斗分出有机层,水层用25mL乙醚萃取,然后合并至有机层,用无水MgSO4干燥.乙醚的作用萃取出水层中溶解的苯甲酸乙酯,提高产率.
(二)制备苯甲酸铜
将苯甲酸加入到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2粉未,然后水浴加热,于70~80℃下保温2~3小时;趁热过滤,滤液蒸发冷却,析出苯甲酸铜晶体,过滤、洗涤、干燥得到成品.
(5)混合溶剂中乙醇的作用是增大苯乙酸的溶解度,便于充分反应,趁热过滤的原因苯甲酸铜冷却后会结晶析出,如不趁热过滤会损失产品
(6)洗涤苯甲酸铜晶体时,下列洗涤剂最合适的是C
A.冷水B.热水C.乙醇D.乙醇水混合溶液.
| A. | 将煤气化后再作为能源,可减少PM2.5引起的危害 | |
| B. | 农作物秸秆处理起来麻烦,利用价值低,适于就地露天焚烧 | |
| C. | 雾霾是一种分散系,分散剂是空气,带活性炭口罩防雾霾的原理是吸附原理 | |
| D. | “地沟油”经过加工处理后,可以用来制肥皂和生物柴油,可以实现厨余废物合理利用 |
| A. | 10mL质量分数为98%的H2SO4,用10mL水稀释后,H2SO4的质量分数大于49% | |
| B. | 配制0.1mol/L的Na2CO3溶液480mL,需用500mL容量瓶 | |
| C. | 在标况下,将22.4L氨气溶于1L水中,得到1mol/L的氨水 | |
| D. | 同温同压下,20mLCH4和60mLO2所含的原子数之比为5:6 |
A$\stackrel{X}{→}$B$\stackrel{O_{2}}{→}$C$\stackrel{O_{2}}{→}$D.
| A. | 当A是正盐,X是强酸时,D是酸性氧化物 | |
| B. | 当X时强碱溶液时,B一定时NH3 | |
| C. | B可能是单质 | |
| D. | D可能是一种酸 |