题目内容
不同元素的气态原子失去最外层一个电子所需要的能量(设其为E)如图所示.试根据元素在周期表中的位置,分析图中曲线的变化特点,并回答下列问题.1至19号元素气态原子失去最外层一个电子所需能量:
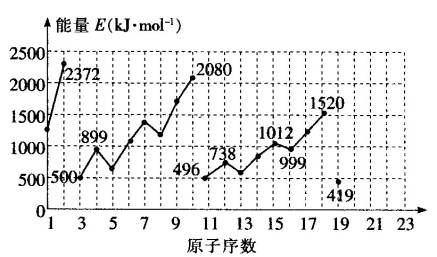
(1)同主族内不同元素的E值变化的特点是______________________,各主族中E值的这种变化特点体现了元素性质的________变化规律.
(2)同周期内,随原子序数增大,E值增大.但个别元素的E值出现反常现象,试预测下列关系中正确的是________(填写编号,多选倒扣).
①E(砷)>E(硒);②E(砷)<E(硒);
③E(溴)>E(硒);④E(溴)<E(硒).
(3)估计1 mol气态Ca原子失去最外层一个电子所需能量E值的范围________<E<________.
(4)10号元素E值较大的原因是______________________.
答案:
解析:
提示:
解析:
| (1)随着原子序数增大,E值变小;周期性;(2)①、③;(3)419;738或填E(钾)、E(镁);(4)10号元素是氖,该元素原子的最外层电子排布已达到8个电子稳定结构。
|
提示:
| (1)同主族元素最外层电子数相同,从上到下原子核电荷数逐渐增大,原子核对最外层电子的吸引力逐渐减小,因此失去最外层电子所需能量逐渐减小。这充分体现了元素性质周期性变化的规律。
(2)根据图可知,同周期元素E(氮)>E(氧),E(磷)>E(硫)。E值出现反常现象。故可推知第四周期E(砷)>E(硒)。但ⅥA族元素和ⅦA族元素的E值并未出现反常,所以E(溴)>E(硒)。此处应填①、③。 (3)1 mol气态Ca原子失去最外层一个电子比同周期元素钾要难,比同主族元素Mg要容易,故其E值应在419~738之间。 (4)10号元素是Ne,它的原子最外层已经成为8电子稳定结构,故其E值较大
|

练习册系列答案
相关题目



