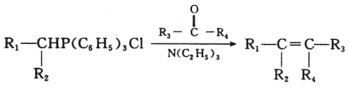题目内容
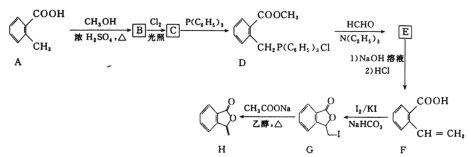
【题目】我国国家标准(GB2760-2011)规定葡萄酒中SO2最大使用量为0.25gL-1。某兴趣小组用图1装置(夹持装置略)收集某葡萄酒中SO2,并对其含量进行测定。
(1)仪器A的名称是 ______,水通入A的进口为 ______。
(2)B中加入300.00mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应,其化学方程式为 ______
(3)除去C中过量的H2O2,然后用0.090 0molL-1NaOH标准溶液进行滴定,滴定前排气泡时,应选择图2中的 ______ ;若滴定终点时溶液的pH=8.8,则选择的指示剂为 ______ ;若用50mL滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积(填序号) ______ (①=10mL;②=40mL;③<10mL;④>40mL)
(4)滴定至终点时,消耗NaOH溶液25.00mL,该葡萄酒中SO2含量为:______ gL-1。
(5)该测定结果比实际值偏高,分析原因并利用现有装置提出改进措施:______。
(6)常温下,用一定量的NaOH溶液吸收逸出的SO2气体,吸收后的吸收液恰好呈中性,下列关于吸收液的说法正确的是______
A. ![]()
B. ![]()
C. ![]()
D. ![]()
E. 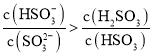
【答案】冷凝管 b ![]() ③ 酚酞 ④ 0.24 原因:盐酸的挥发,改进措施:用不挥发的强酸如硫酸代替盐酸,或用蒸馏水代替葡萄酒进行对比实验 ADE
③ 酚酞 ④ 0.24 原因:盐酸的挥发,改进措施:用不挥发的强酸如硫酸代替盐酸,或用蒸馏水代替葡萄酒进行对比实验 ADE
【解析】
(1)仪器A是冷凝管,为使冷凝效果好,所以b端是进水口,a端是出水口;
(2)二氧化硫与过氧化氢发生氧化还原反应生成硫酸;
(3)NaOH溶液应用碱式滴定管盛放,排气泡时应使尖嘴部分向上弯曲;滴定后的溶液显弱碱性,所以选择酚酞作指示剂,滴定管的液面在刻度“10”处;
(4)根据滴定消耗体积进行计算;
(5)该测定结果比实际值偏高,说明消耗氢氧化钠溶液的体积多,则待测液中的酸多,这是因为盐酸易挥发,使溶液酸的物质的量增大;
(6)根据离子浓度大小分析判断。
![]() 根据仪器A的构造可知,仪器A为冷凝管,冷凝管中通水方向采用逆向通水法,冷凝效果最佳,所以应该进水口为b;
根据仪器A的构造可知,仪器A为冷凝管,冷凝管中通水方向采用逆向通水法,冷凝效果最佳,所以应该进水口为b;
![]() 双氧水具有氧化性,能够将二氧化硫氧化成硫酸,反应的化学方程式为:
双氧水具有氧化性,能够将二氧化硫氧化成硫酸,反应的化学方程式为:![]() ;
;
![]() 氢氧化钠溶液为碱性溶液,应该使用碱式滴定管,碱式滴定管中排气泡的方法:把滴定管的胶头部分稍微向上弯曲,再排气泡,所以排除碱式滴定管中的空气用
氢氧化钠溶液为碱性溶液,应该使用碱式滴定管,碱式滴定管中排气泡的方法:把滴定管的胶头部分稍微向上弯曲,再排气泡,所以排除碱式滴定管中的空气用![]() 的方法;滴定终点时溶液的
的方法;滴定终点时溶液的![]() ,应该选择酚酞做指示剂
,应该选择酚酞做指示剂![]() 酚酞的变色范围是
酚酞的变色范围是![]() ;若用50mL滴定管进行实验,当滴定管中的液面在刻度“10”处,滴定管的0刻度在上方,10mL刻度线下方还有40mL有刻度的溶液,另外滴定管50mL刻度线下有液体,因此管内的液体体积
;若用50mL滴定管进行实验,当滴定管中的液面在刻度“10”处,滴定管的0刻度在上方,10mL刻度线下方还有40mL有刻度的溶液,另外滴定管50mL刻度线下有液体,因此管内的液体体积![]() ,所以
,所以![]() 正确;
正确;
![]() 根据
根据![]() 可知
可知![]() 的质量为:
的质量为:![]() ,该葡萄酒中的二氧化硫含量为:
,该葡萄酒中的二氧化硫含量为:![]() ;
;
![]() 由于盐酸是挥发性酸,挥发的酸消耗氢氧化钠,使得消耗的氢氧化钠溶液体积增大,测定结果偏高;因此改进的措施为:用不挥发的强酸,如硫酸代替盐酸,或用蒸馏水代替葡萄酒进行对比实验,扣除盐酸挥发的影响;
由于盐酸是挥发性酸,挥发的酸消耗氢氧化钠,使得消耗的氢氧化钠溶液体积增大,测定结果偏高;因此改进的措施为:用不挥发的强酸,如硫酸代替盐酸,或用蒸馏水代替葡萄酒进行对比实验,扣除盐酸挥发的影响;
![]() 常温下,用一定量的NaOH溶液吸收逸出的
常温下,用一定量的NaOH溶液吸收逸出的![]() 气体,吸收后的吸收液恰好呈中性,
气体,吸收后的吸收液恰好呈中性,![]() ,
,
A.依据溶液中电荷守恒:![]() ,得到
,得到![]() ,选项A正确;
,选项A正确;
B.若![]() ,溶液呈酸性
,溶液呈酸性![]() ,选项B错误;
,选项B错误;
C.物料守恒可知亚硫酸氢钠和亚硫酸钠按照1:1混合,溶液呈碱性,溶液中物料守恒为![]() ,但溶于呈中性,亚硫酸氢钠和亚硫酸钠的物质的量不同,选项C错误;
,但溶于呈中性,亚硫酸氢钠和亚硫酸钠的物质的量不同,选项C错误;
D.依据化学式可知,亚硫酸氢钠中硫元素物质的量和钠物质的量相同,亚硫酸钠中钠离子大于亚硫酸根中硫元素,所以![]() ,选项D正确;
,选项D正确;
E、

![]()
则 ,选项E正确;
,选项E正确;
答案选ADE。

 阅读快车系列答案
阅读快车系列答案