��Ŀ����
����Ŀ��ijУ��ѧ�о���ѧϰС�������ʵ����֤Fe��Cu�Ľ�����ԣ�����������������ַ��������������������й�ʵ����Ŀ��
�������������������С��ȵ���Ƭ��ͭƬ���ֱ�ͬʱ����ϡ����(��ϡ����)�У��۲�������ݵĿ������ݴ�ȷ�����ǵĻ�ԡ���ԭ�������ӷ���ʽΪ___________________��
����������������Fe��Cu���缫��Ƴ�ԭ��أ���ȷ�����ǵĻ�ԡ���������ķ����ڻ���ԭ���װ��ͼ�����ԭ��صĵ缫���Ϻ͵������Һ����д���缫��Ӧʽ��

������Ӧʽ��____________________��
������Ӧʽ��____________________��
���������������ѧ��֪ʶ���������������һ����֤Fe��Cu��Եļ�ʵ�鷽��(�뷽��������������ͬ)��________________�������ӷ���ʽ��ʾ�䷴Ӧԭ����_____________________��
���𰸡���������Fe��2H��===Fe2����H2����
��������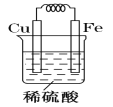 ��2H++2e-=H2����Fe-2e-=Fe2+��������:����Ƭ����CuSO4��Һ�����������渲��һ��ͭ��˵��Fe��Cu���ǿ��Fe��Cu2��===Fe2����Cu(��������)��
��2H++2e-=H2����Fe-2e-=Fe2+��������:����Ƭ����CuSO4��Һ�����������渲��һ��ͭ��˵��Fe��Cu���ǿ��Fe��Cu2��===Fe2����Cu(��������)��
��������
�������������I�����ݽ����˳�����ֻ�����������ϡ���ᷴӦ����Fe��2H��=Fe2����H2��������II�������ǣ�1���ķ�Ӧ��ԭ���װ��Ϊ�� ��������ӦʽΪ2H����2e��=H2����������ӦʽΪFe��2e��=Fe2��������III�����ݽ����˳��������ܰ�ͭ�û���������ˣ�����Ƭ����CuSO4��Һ�����������渲��һ��ͭ��˵��Fe��Cu���ǿ��Fe��Cu2��===Fe2����Cu(��������)��
��������ӦʽΪ2H����2e��=H2����������ӦʽΪFe��2e��=Fe2��������III�����ݽ����˳��������ܰ�ͭ�û���������ˣ�����Ƭ����CuSO4��Һ�����������渲��һ��ͭ��˵��Fe��Cu���ǿ��Fe��Cu2��===Fe2����Cu(��������)��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����Ŀ��ʵ��������ͼװ����������������ĸ�ʵ�飬�����ﵽʵ��Ŀ����
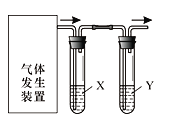
ѡ�� | ʵ��Ŀ�� | �Լ�X | �Լ�Y |
A | ��֤C2H5OH��ŨH2SO4������170�����õ���ϩ������ | NaOH��Һ | Br2ˮ |
B | ����FeSO4���ȷֽ��������������SO3��SO2 | BaCl2��Һ | Ʒ����Һ |
C | ��֤��ʯ�뱥��ʳ��ˮ��Ӧ���ɵ���Ȳ������ | CuSO4��Һ | KMnO4��Һ |
D | ��֤�����ԣ�Cl2��Br2��I2 | NaBr��Һ | KI��Һ |