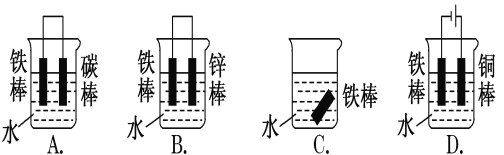
题目内容
【题目】砷的常见酸性氧化物有As2O3和As2O5,根据图中信息回答下列问题:
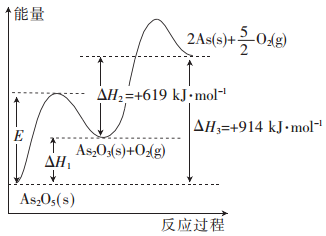
(1)As2O5分解生成As2O3和O2的反应中,加入催化剂,E__________(填“增大”、“减小”或 “不变”,下同),△H1_________。
(2)As2O3分解生成As和O2的热化学方程式为____________________。
(3)As2O3和O2反应生成As2O5的热化学方程式为_____________________。
(4)若1 mol As2O5分解生成0.4 mol As2O3和1.2 mol As,则该分解过程中,需吸收的总能量为_________kJ。
【答案】(1)减小;不变;(2)As2O3(s)=2As(s)+3/2O2(g) △H=+619kJ·mol-1;
(3) As2O3(s)+O2(g)=As2O3(s) △H=-295kJ·mol-1 ; (4)666.4。
【解析】
试题分析:(1)使用催化剂降低活化分子的活化能,E代表活化能,因此减小,反应热只跟始态和终态有关,跟途径无关,因此反应热不变;(2)根据示意图,As2O3(s)=As(s)+3/2O2(g) △H=+619kJ·mol-1;(3)As2O3(s)+O2(g)=As2O5(s) △H=(619 - 914) kJ·mol-1 = -295 kJ·mol-1;(4)生成0.4molAs2O3吸收能量0.4 × 295kJ = 118 kJ,生成1.2molAs吸收能量1.2 × 914/2 kJ = 548.4 kJ,因此共吸收的能量为118 + 548.4 = 666.4 kJ。

 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案【题目】以下判断,结论正确的是
选项 | 项目 | 结论 |
A | 三种有机化合物:丙烯、氯乙烯、苯 | 分子内所有原子均在同一平面 |
B | 由溴丙烷水解制丙醇;由丙烯与水反应制丙醇 | 属于同一反应类型 |
C | 乙烯和苯都能使溴水褪色 | 褪色的原理相同 |
D | C4H9Cl的同分异构体数目(不考虑立体异构) | 共有4种 |
A. A B. B C. C D. D