题目内容
【题目】在1×105Pa和298K时,将1mol气态AB分子分离成气态A原子和B原子所需要的能量称为键能(kJ·mol-1)。下面是一些共价键的键能:(已知氨分子中有三个等价的氮氢共价键)
共价键 | H2分子 | N2分子 | NH3分子 |
键能(kJ·mol-1) | 436 | 945 | 391 |
(1)根据上表中的数据判断工业合成氨的反应是__(填“吸热”或“放热”)反应;
(2)在298K时,取1molN2和3molH2放入一密闭容器中,在催化剂存在下进行反应,理论上生成2molNH3时放出或吸收的热量为Q,则Q为___。
【答案】放热 93kJ
【解析】
(1)化学反应中,化学键断裂吸收能量,形成新化学键放出能量,根据方程式以及反应物、生成物的键能分别计算吸收和放出的能量,以此计算判断吸热还是放热;
(2)根据反应热=反应物总键能-生成物总键能计算生成2molNH3时的能量变化。
(1)在反应N2+3H2![]() 2NH3中,断裂1mol N
2NH3中,断裂1mol N![]() N键、3mol H-H键共吸收的能量为945kJ+3×436kJ=2253kJ,生成2mol NH3,共形成6mol N-H键,放出的能量为6×391kJ=2346kJ,吸收的能量少,放出的能量多,该反应为放热反应;
N键、3mol H-H键共吸收的能量为945kJ+3×436kJ=2253kJ,生成2mol NH3,共形成6mol N-H键,放出的能量为6×391kJ=2346kJ,吸收的能量少,放出的能量多,该反应为放热反应;
(2)反应热=反应物总键能-生成物总键能,反应N2+3H2![]() 2NH3
2NH3 ![]() ,即理论上生成2molNH3时放出的热量Q为93kJ。
,即理论上生成2molNH3时放出的热量Q为93kJ。

 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案【题目】化工原料异丁烯(C4H8)可由异丁烷(C4H10)直接催化脱氢制备:C4H10(g) ![]() C4H8(g) + H2(g)ΔH=+139 kJ/mol
C4H8(g) + H2(g)ΔH=+139 kJ/mol
(1)该反应的化学平衡常数的表达式为_________________。
(2)一定条件下,以异丁烷为原料生产异丁烯。温度、压强改变对异丁烷平衡转化率的
影响如下图所示。
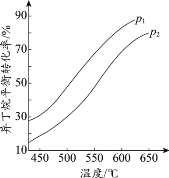
①判断p1、p2的大小关系:p1_________________(填“>”或“<”)p2,理由是_________________。
②若异丁烷的平衡转化率为40%,则平衡混合气中异丁烯的物质的量分数最多为______%(保留小数点后1位)。
(3)目前,异丁烷催化脱氢制备异丁烯的研究热点是催化活性组分以及载体的选择。下表是以V-Fe-K-O为催化活性物质,反应时间相同时,测得的不同温度、不同载体条件下的数据。
温度/℃ | 570 | 580 | 590 | 600 | 610 | |
以γ-Al2O3为载体 | 异丁烷转化率/% | 36.41 | 36.49 | 38.42 | 39.23 | 42.48 |
异丁烯收率/% | 26.17 | 27.11 | 27.51 | 26.56 | 26.22 | |
以TiO2为载体 | 异丁烷转化率/% | 30.23 | 30.87 | 32.23 | 33.63 | 33.92 |
异丁烯收率/% | 25.88 | 27.39 | 28.23 | 28.81 | 29.30 | |
说明:收率=(生产目标产物的原料量/原料的进料量)×100%
①由上表数据,可以得到的结论是____________(填字母序号)。
a.载体会影响催化剂的活性
b. 载体会影响催化剂的选择性
c.载体会影响化学平衡常数
②分析以γ-Al2O3为载体时异丁烯收率随温度变化的可能原因:___________。
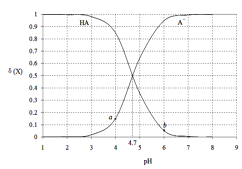
【题目】现有室温下四种溶液,有关叙述不正确的是
编号 | ① | ② | ③ | ④ |
pH | 10 | 10 | 4 | 4 |
溶液 | 氨水 | 氢氧化钠溶液 | 醋酸溶液 | 盐酸 |
A. 相同体积③、④溶液分别与NaOH完全反应,消耗NaOH物质的量:③>④
B. 分别加水稀释10倍,四种溶液的pH:①>②>④>③
C. ①、④两溶液等体积混合,所得溶液中c(NH4+)>c(Cl-)>c(OH-)>c(H+)
D. VaL④溶液与VbL②溶液混合(近似认为混合溶液体积=Va+Vb),若混合后溶液pH=5,则Va︰Vb=9︰11