题目内容
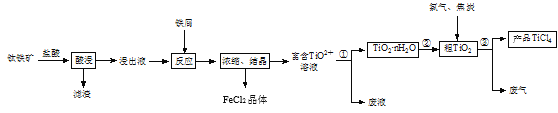
【题目】四氯化钛(TiCl4)是制取航空材料——钛合金的重要原料。由钛铁矿(主要成分是FeTiO3,不溶于水)制备TiCl4等产品的一种工艺流程示意如图:
回答下列问题:
(1)“酸浸”时需要将钛铁矿粉碎,其目的是____。
(2)浸出液呈强酸性,含有TiO2+、Fe2+及少量Fe3+、Al3+等离子,则生成TiO2+的离子方程式是__。
(3)“反应”时需加入铁屑至浸出液显紫色,此时溶液仍呈强酸性。该过程中有如下反应发生:
2Fe3++Fe=3Fe2+
2TiO2+(无色)+Fe+4H+=2Ti3+(紫色)+Fe2++2H2O
Ti3+(紫色)+Fe3++H2O=TiO2+(无色)+Fe2++2H+
加入铁屑的作用是____。
(4)通过控制条件,可以使过程①中生成的TiO2·nH2O形成一种液态分散系,用一束光照射该分散系能够产生丁达尔效应,则分散质颗粒直径的范围是____。
(5)过程①制得的固体TiO2·nH2O需用过量酸清洗以除去其中的Fe(OH)3杂质,检验Fe(OH)3杂质除净的实验方法是____。
(6)过程③生成的废气中含有CO,则TiO2和焦炭、氯气在高温下发生反应的化学方程式是___。
(7)上述工艺具有成本低、可用低品位矿物为原料等优点。依据绿色化学理念,该工艺流程中存在的不足之处是____(只要求写出一项)。
(8)依据表中信息,可采用___方法精制含少量SiCl4杂质的TiCl4。
TiCl4 | SiCl4 | |
熔点/℃ | -25.0 | -68.8 |
沸点/℃ | 136.4 | 57.6 |
【答案】增大接触面积,加快反应速率 FeTiO3+4H+=TiO2++Fe2++2H2O 将Fe3+还原为Fe2+ 10-9~10-7m 用试管取少量最后一次洗涤液,加入KSCN溶液,若溶液未变为血红色,则说明Fe(OH)3杂质已除净 TiO2+2C+2Cl2![]() TiCl4+2CO 过程③中产生的CO和残留的Cl2有毒,污染空气 蒸馏
TiCl4+2CO 过程③中产生的CO和残留的Cl2有毒,污染空气 蒸馏
【解析】
(1)将钛铁矿粉碎,可以增大固体反应物的接触面积,加快反应速率;
故答案为:增大接触面积,加快反应速率;
(2)根据已知信息,确定部分反应物FeTiO3和生成物TiO2+、Fe2+,再结合元素守恒,电荷守恒配平生成TiO2+的离子方程式为FeTiO3+4H+=TiO2++Fe2++2H2O;
故答案为:FeTiO3+4H+=TiO2++Fe2++2H2O;
(3)根据题意:浸出液中含有少量Fe3+,而浸出液加入铁粉后浓缩、结晶得到FeCl2晶体,因此加入铁粉的目的是将Fe3+还原为Fe2+,加入铁屑至浸出液显紫色,说明Fe3+已完全被还原为Fe2+;
故答案为:将Fe3+还原为Fe2+;
(4)能够产生丁达尔效应的分散系为胶体,则分散质颗粒直径的范围是10-9~10-7m;
故答案为:10-9~10-7m;
(5)过量酸将Fe(OH)3中和为Fe3+,用试管取少量最后一次洗涤液,加入KSCN溶液,若溶液未变为血红色,则说明Fe(OH)3杂质已除净;
故答案为:用试管取少量最后一次洗涤液,加入KSCN溶液,若溶液未变为血红色,则说明Fe(OH)3杂质已除净;
(6)过程③反应物为TiO2、氯气、焦炭,生成的废气中含有CO,根据得失电子守恒、元素守恒写出方程式,则TiO2和焦炭、氯气在高温下发生反应的化学方程式是TiO2+2C+2Cl2![]() TiCl4+2CO;
TiCl4+2CO;
故答案为:TiO2+2C+2Cl2![]() TiCl4+2CO;
TiCl4+2CO;
(7)依据绿色化学理念,该工艺流程中存在的不足之处是过程③中产生的CO和残留的Cl2有毒,污染空气;
故答案为:过程③中产生的CO和残留的Cl2有毒,污染空气;
(8)SiCl4、TiCl4为液态混合物,沸点相差较大,因此可用蒸馏的方法提纯TiCl4;
故答案为:蒸馏。

【题目】在1×105Pa和298K时,将1mol气态AB分子分离成气态A原子和B原子所需要的能量称为键能(kJ·mol-1)。下面是一些共价键的键能:(已知氨分子中有三个等价的氮氢共价键)
共价键 | H2分子 | N2分子 | NH3分子 |
键能(kJ·mol-1) | 436 | 945 | 391 |
(1)根据上表中的数据判断工业合成氨的反应是__(填“吸热”或“放热”)反应;
(2)在298K时,取1molN2和3molH2放入一密闭容器中,在催化剂存在下进行反应,理论上生成2molNH3时放出或吸收的热量为Q,则Q为___。