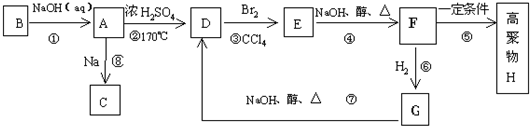
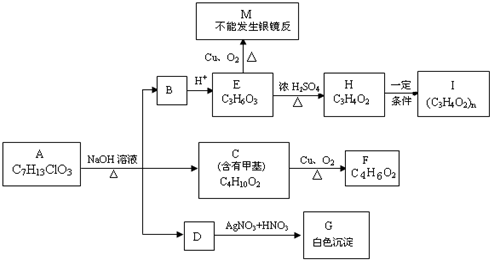
题目内容
X、Y、Z、W是元素周期表前四周期中常见的元素,其相关信息如下表:
(1)W位于元素周期表第 周期第 族,基态W2+的核外电子排布式为 _.
(2)X的电负性比Y的 (填“大”或“小”);X 和Y形成的XY32-离子中,中心原子的杂化类型是 ,其离子的空间构型为为 .
(3)写出Z2Y2的电子式 ,指出其中含有的化学键 ;XY2形成的晶体类型为 .
| 元素 | 相 关 信 息 |
| X | X的基态原子L层电子数是K层电子数的2倍 |
| Y | Y的基态原子最外层电子排布式为:nsnnpn+2 |
| Z | Z的一中核素中子数为12,质量数为23 |
| W | W有多种化合价,其白色氢氧化合物在空气中会迅速变成灰绿色,最后变成红褐色 |
(2)X的电负性比Y的
(3)写出Z2Y2的电子式
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:X原子的L层电子数是K层电子数的2倍,应为C元素,Y原子的最外层电子排布式为:nsnnpn+2,n=2,则最外层电子排布式为:2s22p4,应为O元素,Z存在质量数为23,中子数为12的原子核,质子数应为23-12=11,则为Na元素,W有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色,应为氢氧化亚铁和氢氧化铁的转化,则W为Fe元素,结合对应单质、化合物的性质以及元素周期律知识解答该题.
解答:
解:原子的L层电子数是K层电子数的2倍,应为C元素,Y原子的最外层电子排布式为:nsnnpn+2,n=2,则最外层电子排布式为:2s22p4,应为O元素,Z存在质量数为23,中子数为12的原子核,质子数应为23-12=11,则为Na元素,W有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色,应为氢氧化亚铁和氢氧化铁的转化,则W为Fe元素,
(1)W为Fe元素,核外价层电子排布为3d64s2,位于元素周期表第四周期第Ⅷ族;同一种失去2个电子生成亚铁离子,则基态Fe2+的核外电子排布式为:1s22s22p63s23p63d6,
故答案为:四;Ⅷ; 1s22s22p63s23p63d6;
(2)X为C元素,Y为O元素,位于周期表同一周期,非金属性C<O,电负性大小为:C<O;
X和Y形成的XY32-离子为碳酸根离子,CO32-中碳原子的价层电子数为:3+
=3,为sp2杂化,不含孤电子对,所以其空间构型是平面正三角形,
故答案为:小;sp2;平面三角形;
(3)Z2Y2为Na2O2,为离子混合物,过氧化钠的电子式为: ,过氧化钠中含有离子键和共价键;
,过氧化钠中含有离子键和共价键;
XY2为CO2,二氧化碳晶体的通过分子间作用力形成的,属于分子晶体,
故答案为: ; 分子晶体.
; 分子晶体.
(1)W为Fe元素,核外价层电子排布为3d64s2,位于元素周期表第四周期第Ⅷ族;同一种失去2个电子生成亚铁离子,则基态Fe2+的核外电子排布式为:1s22s22p63s23p63d6,
故答案为:四;Ⅷ; 1s22s22p63s23p63d6;
(2)X为C元素,Y为O元素,位于周期表同一周期,非金属性C<O,电负性大小为:C<O;
X和Y形成的XY32-离子为碳酸根离子,CO32-中碳原子的价层电子数为:3+
| 4+2-2×3 |
| 2 |
故答案为:小;sp2;平面三角形;
(3)Z2Y2为Na2O2,为离子混合物,过氧化钠的电子式为:
 ,过氧化钠中含有离子键和共价键;
,过氧化钠中含有离子键和共价键;XY2为CO2,二氧化碳晶体的通过分子间作用力形成的,属于分子晶体,
故答案为:
 ; 分子晶体.
; 分子晶体.
点评:本题考查位置结构性质的关系的综合应用,根据原子结构特点正确推断元素的种类为解答该题的关键,本题侧重于物质的位置、电子式、结构以及性质的考查,注意把握相关基础知识.

练习册系列答案
 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案
相关题目
下列各组物质的稀溶液相互反应,把前者逐滴滴入后者与把后者逐滴滴入前者,所产生的现象相同的是( )
| A、AlCl3 和NaOH |
| B、Na2CO3和HCl |
| C、NaHCO3和HCl |
| D、NaAlO2和HCl |
下列物质的分类正确的是( )
| 碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 | |
| A | Na2CO3 | H2SO4 | NaOH | SO2 | CO2 |
| B | NaOH | HCl | NH4Cl | Na2O | CO |
| C | NH3?H2O | CH3COOH | NaCl | Na2O2 | SO2 |
| D | KOH | HNO3 | CaCO3 | CaO | SO2 |
| A、A | B、B | C、C | D、D |
如图所示,电极a和b均为石墨棒,在电解过程中,下列说法正确的是( )
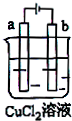

| A、电极a表面呈红色 |
| B、电极b表面有气泡生成 |
| C、电子由电源的正极沿导线流向电极a |
| D、该装置能量转化形式为电能转化为化学能 |
 化合物A(C4H10O)是一种有机溶剂.A可以发生如下变化:
化合物A(C4H10O)是一种有机溶剂.A可以发生如下变化: