题目内容
中学化学教材中有大量数据,下面是某同学对数据的利用情况,其中不正确的是( )
| A、利用焓变和熵变的数据可以确定一定温度、压强下化学反应过程是否一定会发生 |
| B、利用化学平衡常数的大小可判断化学反应可能进行的程度 |
| C、利用焓变的数据可以判断一个反应是吸热反应还是放热反应 |
| D、利用沸点的数据推测能否用蒸馏的方法将两种液体混合物进行分离 |
考点:焓变和熵变,反应热和焓变,化学平衡常数的含义,物质的分离、提纯和除杂
专题:基本概念与基本理论,化学应用
分析:A.能自发进行的反应不一定会发生;
B.平衡常数越大,反应物的转化率越大;
C.放热反应△H<0,吸热反应△H>0;
D.蒸馏是利用两种相互溶解的物质沸点不同而分离物质的方法.
B.平衡常数越大,反应物的转化率越大;
C.放热反应△H<0,吸热反应△H>0;
D.蒸馏是利用两种相互溶解的物质沸点不同而分离物质的方法.
解答:
解:A.利用焓变和熵变的数据可以确定一定温度、压强下化学反应的自发趋势,即反应的可能性,不能说明该反应过程是否一定发生,故A错误;
B.平衡常数为生成物的浓度幂之积除以反应物的浓度幂之积,生成物浓度越大,反应物浓度越小,则平衡常数越大,可说明反应物的转化率越大,故B正确;
C.放热反应△H<0,吸热反应△H>0,所以利用焓变的数据可以判断一个反应是吸热反应还是放热反应,故C正确;
D.沸点不同的液体混合物,如沸点较差较大,可用蒸馏的方法分离,故D正确;
故选:A.
B.平衡常数为生成物的浓度幂之积除以反应物的浓度幂之积,生成物浓度越大,反应物浓度越小,则平衡常数越大,可说明反应物的转化率越大,故B正确;
C.放热反应△H<0,吸热反应△H>0,所以利用焓变的数据可以判断一个反应是吸热反应还是放热反应,故C正确;
D.沸点不同的液体混合物,如沸点较差较大,可用蒸馏的方法分离,故D正确;
故选:A.
点评:本题为综合题,涉及物质的分离、平衡常数、焓变与熵变等知识,熟悉蒸馏的原理、平衡常数的意义、反应自发进行的判断依据是解题关键,难度不大,注意相关基础知识的积累.

练习册系列答案
相关题目
用NA表示阿伏加德罗常数,下列叙述正确的是( )
| A、常温常压下,1.06gNa2CO3含有的Na+离子数为0.02 NA |
| B、标准状况下,0.5 mol/LBaCl2溶液中含有Cl-离子数为NA |
| C、通常状况下,NA个CO2分子占有的体积为22.4L |
| D、2.7g铝与盐酸完全反应失去0.2NA个电子 |
下列说法正确的是( )
| A、由于氧化性HNO3大于H2SO4,所以非金属性:氮大于硫 |
| B、科学家在金属和非金属交界线处寻找催化剂 |
| C、只有主族元素是由短周期和长周期元素共同构成的 |
| D、长周期主族元素X的阳离子X2+的最外层有2个电子,则它是IVA族元素 |
在一密闭容器中,N2、H2合成氨的反应已达到平衡.此时再往容器中通入一定量N2气体,保持温度和容器体积不变,当反应再次达到平衡时,与第一次平衡状态相比( )
| A、NH3的百分含量增大 |
| B、NH3的浓度增大 |
| C、H2的转化率不变 |
| D、N2的转化率提高 |
下列关于苯乙烯(结构简式: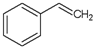 )的叙述,错误的是( )
)的叙述,错误的是( )
 )的叙述,错误的是( )
)的叙述,错误的是( )| A、可以与溴水反应 |
| B、能够使酸性高锰酸钾溶液褪色 |
| C、分子式C8H8 |
| D、1mol苯乙烯可以和1molH2发生加成反应 |
已知维生素A的结构简式可写为 ,式中以线表示键,线的交点与端点处代表碳原子,并用氢原子数补足四价,但C、H未标出来.关于它的叙述正确的( )
,式中以线表示键,线的交点与端点处代表碳原子,并用氢原子数补足四价,但C、H未标出来.关于它的叙述正确的( )
 ,式中以线表示键,线的交点与端点处代表碳原子,并用氢原子数补足四价,但C、H未标出来.关于它的叙述正确的( )
,式中以线表示键,线的交点与端点处代表碳原子,并用氢原子数补足四价,但C、H未标出来.关于它的叙述正确的( )| A、维生素A的分子式为C20H30O |
| B、维生素A是一种易溶于水的醇 |
| C、维生素A的分子中有苯环结构并能使酸性高锰酸钾溶液褪色 |
| D、1 mol维生素A在催化剂的作用下最多可与5 mol H2发生加成反应 |
下列关于有机物的叙述不正确的是( )
| A、油脂在空气中完全燃烧生成二氧化碳和水 |
| B、蛋白质溶液中加入浓的硫酸铵溶液会发生盐析 |
| C、乙酸乙酯中混有的乙酸杂质可以用饱和碳酸钠溶液除去 |
| D、由CH2=CH-COOCH3合成的聚合物为[CH2-CH-COOCH3]n |
下列变化中,物质被氧化的是( )
| A、CaO→Ca(OH)2 |
| B、Cu2+→Cu |
| C、Fe2+→Fe3+ |
| D、CO2→CO |