题目内容
依据事实,写出下列反应的热化学方程式.
(1)在25℃、101kPa下,1g CH3OH(l)燃烧生成CO2和液态水时放热QkJ.则表示甲醇燃烧热的热化学方程式为
(2)若适量的N2和O2完全反应,每生成15克NO需要吸收16.95kJ热量.则热化学方程式为 .
(1)在25℃、101kPa下,1g CH3OH(l)燃烧生成CO2和液态水时放热QkJ.则表示甲醇燃烧热的热化学方程式为
(2)若适量的N2和O2完全反应,每生成15克NO需要吸收16.95kJ热量.则热化学方程式为
考点:反应热和焓变,热化学方程式
专题:化学反应中的能量变化
分析:(1)依据燃烧热概念是1mol可燃物完全燃烧生成稳定氧化物放出的热量,题干所给量计算32g甲醇燃烧生成二氧化碳和液态水放热,结合热化学方程式书写方法,标注物质聚集状态和对应焓变;
(2)根据热化学方程式的书写方法结合热化学方程式的意义来回答.
(2)根据热化学方程式的书写方法结合热化学方程式的意义来回答.
解答:
解:(1)在25℃、101kPa下,1g甲醇(CH3OH)燃烧生成CO2和液态水时放热QkJ.32g甲醇燃烧生成二氧化碳和液态水放出热量为32QKJ;则表示甲醇燃烧热的热化学方程式为:CH3OH(l)+
O2(g)=CO2(g)+2H2O(l)△H=-32QkJ?mol-1,
故答案为:CH3OH(l)+
O2(g)=CO2(g)+2H2O(l)△H=-32QkJ?mol-1;
(2)适量的N2和O2完全反应,每生成15克NO需要吸收16.95kJ热量,所以每生成60克NO需要吸收67.8kJ热量,则热化学方程式为:N2(g)+O2(g)=2NO(g)△H=67.8kJ?mol-1,
故答案为:N2(g)+O2(g)=2NO(g)△H=67.8kJ?mol-1.
| 3 |
| 2 |
故答案为:CH3OH(l)+
| 3 |
| 2 |
(2)适量的N2和O2完全反应,每生成15克NO需要吸收16.95kJ热量,所以每生成60克NO需要吸收67.8kJ热量,则热化学方程式为:N2(g)+O2(g)=2NO(g)△H=67.8kJ?mol-1,
故答案为:N2(g)+O2(g)=2NO(g)△H=67.8kJ?mol-1.
点评:本题主要考查了热化学方程式的书写,注意把握热化学方程式的意义.

练习册系列答案
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案
相关题目
常温下,下列各组物质不能用一种试剂通过化学反应区别的是( )
| A、MnO2 CuO FeO |
| B、(NH4)2SO4 K2SO4 NH4Cl |
| C、AgNO3 KNO3 Na2CO3 |
| D、Na2CO3 CaCO3 K2CO3 |
现在三组物质的分离:①含有水份的植物油中除去水份②回收碘的CCl4溶液中的CCl4③用食用酒精浸泡中草药提取其中的有效成分.分离以上各混合液的正确方法依次是( )
| A、分液、萃取、蒸馏 |
| B、萃取、蒸馏、分液 |
| C、分液、蒸馏、萃取 |
| D、蒸馏、萃取、分液 |
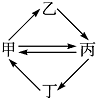 下列各组物质按如图所示转化关系每一步都能一步实现的是( )
下列各组物质按如图所示转化关系每一步都能一步实现的是( )| 甲 | 乙 | 丙 | 丁 | |
| A | FeCl3 | FeCl2 | Fe2O3 | Fe(OH)3 |
| B | Cu | CuO | CuSO4 | CuCl2 |
| C | SO2 | H2SO4 | SO3 | H2S |
| D | Al(OH)3 | NaAlO2 | Al2O3 | AlCl3 |
| A、A | B、B | C、C | D、D |
下列实验操作中错误的是( )
| A、进行蒸发操作时,当有大量晶体析出,就应停止加热 |
| B、进行蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 |
| C、进行分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| D、进行萃取操作时,应选择有机萃取剂,如可用酒精萃取溴水中的溴 |
下列说法正确的是( )
| A、用25ml量筒量取12.3ml盐酸;用托盘天平称取8.75g食盐 |
| B、用pH试纸测得某氯水的pH为2;用标准NaOH溶液滴定未知浓度的盐酸,用去NaOH溶液23.10ml |
| C、将质量分数为5%和25%的氨水等体积混合后,所得溶液中溶质的质量分数大于15% |
| D、浓硝酸必须保存在棕色玻璃瓶中;钠必须保存在煤油中 |
H-是负一价的阴离子,它可与NH3发生以下反应:H-+NH3=H2+NH2-,下列有关这个反应的说法中不正确的是( )
| A、该反应中NH3被还原 |
| B、该反应中H-是还原剂 |
| C、该反应中NH2-是还原产物 |
| D、反应中被氧化和被还原的元素都是H元素 |