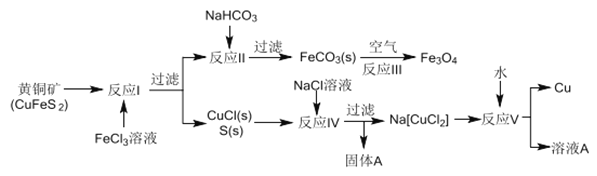
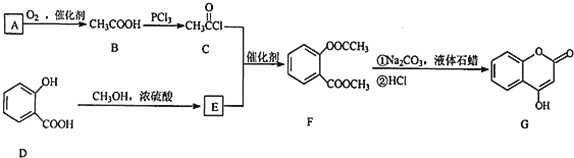
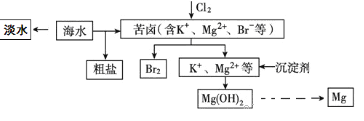
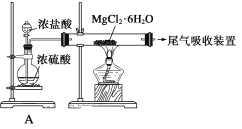
��Ŀ����
����Ŀ���������������������������Ҫԭ��֮һ���������������ж��ַ�����
��1��Ŀǰ��Ӧ����㷺���������������ѳ�������NH3����ԭ������ѧ��Ӧ�ɱ�ʾΪ��2NH3(g)+NO(g)+NO2(g)== 2N2(g)+3H2O(g) ��H��0
�ٸ÷�Ӧ�У���Ӧ��������_____������>������<������=������������������
�ڵ��÷�Ӧ��2mol N2(g)����ʱ��ת�Ƶ��ӵ����ʵ���Ϊ____________mol��
�۸÷�Ӧ�У���ԭ��Ϊ_____________���ѧʽ�������������뻹ԭ�����������Ϊ______________��
��2��Ҳ�������ü������ԭ���������֪��
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ��H=-574kJ/mol
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) ��H=-867kJ/mol
��CH4(g)��NO(g)��ԭΪN2(g)���Ȼ�ѧ����ʽ��_________________________________��
��3����������ClO2���������������Ⱦ����Ӧ�������������ַ�Ӧ�����������ȥ����
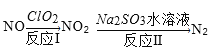
��ӦI�IJ����л�������ǿ�����ɣ�������һ��ǿ��Ϊ���ᣬ��������NO2���ʵ�����ȣ���ѧ��Ӧ����ʽΪ______����Ӧ��������22.4L N2(��״��)��������ClO2______g��
���𰸡� �� 6 NH3 1:1 CH4��g��+4NO��g��=2N2��g��+CO2��g��+2H2O��g����H=��1160kJ��mol��1 2NO + ClO2 + H2O = NO2 + HNO3 + HCl 135
����������1���ٸ÷�Ӧ��H��0���Ƿ��ȷ�Ӧ����Ӧ��������>���������������ڸ÷�ӦNH3(g)��NԪ�ػ��ϼ�Ϊ-3��NO(g)��NԪ�ػ��ϼ�Ϊ+2��NO2(g)��NԪ�ػ��ϼ�Ϊ+4��������N2(g)��NԪ�ػ��ϼ�Ϊ0�����ݻ��ϼ����ߵ���ֵ=���ϼ۽�����ֵ=ת�Ƶ�����������ת�ƹ�ϵΪ��2NH3��6e-���ɻ�ѧ����ʽ�ù�ϵ��2NH3��2N2(g)�����Ե���2molN2(g)����ʱ��ת�Ƶ������ʵ���Ϊ6mol���۸���ǰ��Է�Ӧ��Ԫ�ػ��ϼ۵ķ����ã��÷�Ӧ�У���ԭ��ΪNH3�����������뻹ԭ���ﶼ��N2(g)������Nԭ���غ㼰��ʧ�����غ㣬���������뻹ԭ��������ʵ�����ȣ��������������뻹ԭ����������Ϊ1:1��
��2������֪�е������Ȼ�ѧ����ʽ�ֱ�Ϊ�١��ڣ����ݸ�˹���ɣ�����2-�ٿɵã�CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)��H=-1160kJmol-1��
��3���������̣�һ�������Ͷ������ȷ�Ӧ��NO����ԭ����������ClO2������������ԭ���ٽ����֪��Ϣ�ɵã����������ᡢHCl�Ͷ�����������ѧ����ʽΪ��2NO+ClO2+H2O=NO2+HNO3+HCl�����ݷ�ӦI�ɵã�NO2��ClO2�����ݷ�ӦII��Nԭ���غ�ɵ���2NO2��N2�����2ClO2��2NO2��N2�����Է�Ӧ�������ɱ�״��22.4LN2(��1molN2)��������2molClO2������Ϊ��2mol��67.5gmol-1=135g��

 ����ʦ���һ��һ��ϵ�д�
����ʦ���һ��һ��ϵ�д� �Ͻ�ƽ��У����ϵ�д�
�Ͻ�ƽ��У����ϵ�д�