题目内容
1.有机物X是一种重要的化工原料,主要用于合成维尼纶,也用于粘结剂和涂料工业等化学试剂.工业上利用天然气为原料通过下列转化合成有机物X.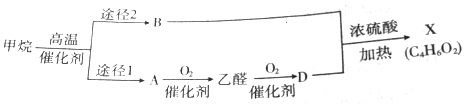
根据以上信息回答下列问题:
(1)已知D能与NaHCO3溶液反应生成CO2,则D的结构简式为CH3COOH
(2)B与D反应生成X的原子利用率为100%,且X分子结构中含有一个甲基,则X的结构简式为CH3COOCH=CH2
(3)已知2mo1CH4在高温催化剂作用下产生A的同时:还生成2molH2,写出甲烷按途径1发生反应的化学方程式:2CH4$→_{催化剂}^{高温}$CH2=CH2+2H2.
分析 D能与NaHCO3溶液反应生成CO2,且可由乙醛氧化生成,则D为CH3COOH,B与D反应生成X的原子利用率为100%,且X分子结构中含有一个甲基,由X的分子式可知B含有2个C,2个H,应为C2H2,则B为CH≡CH,可知X为CH3COOCH=CH2,2mo1CH4在高温催化剂作用下产生A的同时还生成2molH2,可知A含有2个C原子、4个H原子,应为CH2=CH2,以此解答该题.
解答 解:(1)D能与NaHCO3溶液反应生成CO2,且可由乙醛氧化生成,则D为CH3COOH,故答案为:CH3COOH;
(2)由以上分析可知X为CH3COOCH=CH2,故答案为:CH3COOCH=CH2;
(3)A为CH2=CH2,2mo1CH4在高温催化剂作用下产生A的同时:还生成2molH2,则甲烷按途径1发生反应的化学方程式2CH4$→_{催化剂}^{高温}$CH2=CH2+2H2,
故答案为:2CH4$→_{催化剂}^{高温}$CH2=CH2+2H2.
点评 本题考查有机物的推断与合成,是高考的必考题型,涉及官能团的结构与性质、有机物结构等,充分理解题目提供的信息内涵,挖掘隐含信息,寻求信息切入点,难度中等.

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
7.三氯化磷(PCl3)是一种用于有机合成的重要催化剂.实验室常用红磷与干燥的Cl2制取PCl3,装置如图所示.
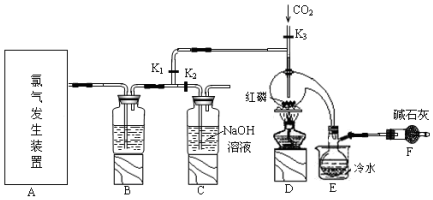
已知:红磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5.PCl3遇O2会生成POCl3(三氯氧磷),POCl3溶于PCl3,PCl3遇水会强烈水解生成H3PO3和HCl.PCl3、POCl3的熔沸点见表.
请答下面问题:
(1)玻璃管之间的连接需要用到胶皮管,连接的方法是:先把玻璃管口用水润湿;,然后稍稍用力即可把玻璃管插入橡皮管.
(2)B中所盛试剂是浓硫酸,F中碱石灰的作用是吸收多余的Cl2,防止空气中的水蒸气进入烧瓶与PCl3反应.
(3)实验时,检查装置气密性后,向D装置的曲颈瓶中加入红磷,打开K3通入干燥的CO2,一段时间后,关闭K3,加热曲颈瓶至上部有黄色升华物出现时通入氯气,反应立即进行.通干燥CO2的作用是排尽装置中的空气,防止红磷与空气中的氧气发生自燃,C装置中的K1、K2的设计也出于类似的目的,为了达到这-实验目的,实验时与K1、K2有关的操作是先关闭K1,打开K2,等B中溶液上方充满黄绿色气体后,打开K1,关闭K2.
(4)实验制得的粗产品中常含有POCl3、PCl5等.加入红磷加热除去PCl5后,通过蒸馏(填实验操作名称),即可得到较纯净的PCl3.
(5)通过下面方法可测定产品中PCl3的质量分数:
①迅速称取1.00g产品,加水反应后配成250mL溶液:
②取以上溶液25.00mL,向其中加入10.00mL0.1000mol/L碘水(足量),充分反应;
③向②所得溶液中加入几滴淀粉溶液,用0.1000mol/L的Na2S2O3溶液滴定;
④重复②、③操作,平均消耗0.1000mol/L Na2S2O3溶液8.00mL.
己知:H3PO3+I2+H2O=H3PO4+2HI,I2+2Na2S2O3=2NaI+Na2S4O6,根据上述数据,假设测定过程中没有其他反应,该产品中PCl3的质量分数为82.5%.

已知:红磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5.PCl3遇O2会生成POCl3(三氯氧磷),POCl3溶于PCl3,PCl3遇水会强烈水解生成H3PO3和HCl.PCl3、POCl3的熔沸点见表.
| 物质 | 熔点/℃ | 沸点/℃ |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
(1)玻璃管之间的连接需要用到胶皮管,连接的方法是:先把玻璃管口用水润湿;,然后稍稍用力即可把玻璃管插入橡皮管.
(2)B中所盛试剂是浓硫酸,F中碱石灰的作用是吸收多余的Cl2,防止空气中的水蒸气进入烧瓶与PCl3反应.
(3)实验时,检查装置气密性后,向D装置的曲颈瓶中加入红磷,打开K3通入干燥的CO2,一段时间后,关闭K3,加热曲颈瓶至上部有黄色升华物出现时通入氯气,反应立即进行.通干燥CO2的作用是排尽装置中的空气,防止红磷与空气中的氧气发生自燃,C装置中的K1、K2的设计也出于类似的目的,为了达到这-实验目的,实验时与K1、K2有关的操作是先关闭K1,打开K2,等B中溶液上方充满黄绿色气体后,打开K1,关闭K2.
(4)实验制得的粗产品中常含有POCl3、PCl5等.加入红磷加热除去PCl5后,通过蒸馏(填实验操作名称),即可得到较纯净的PCl3.
(5)通过下面方法可测定产品中PCl3的质量分数:
①迅速称取1.00g产品,加水反应后配成250mL溶液:
②取以上溶液25.00mL,向其中加入10.00mL0.1000mol/L碘水(足量),充分反应;
③向②所得溶液中加入几滴淀粉溶液,用0.1000mol/L的Na2S2O3溶液滴定;
④重复②、③操作,平均消耗0.1000mol/L Na2S2O3溶液8.00mL.
己知:H3PO3+I2+H2O=H3PO4+2HI,I2+2Na2S2O3=2NaI+Na2S4O6,根据上述数据,假设测定过程中没有其他反应,该产品中PCl3的质量分数为82.5%.
9.下列各组物质的溶液中,不需要外加试剂就能鉴别的一组是( )
| A. | FeCl3、Fe2(SO4)3、Fe(NO3)3、FeBr3 | B. | FeCl3、Na2CO3、NaOH、NaCl | ||
| C. | FeSO4、MgSO4、Na2SO4、H2O2 | D. | FeCl2、NH4Cl、MgCl2、KCl |
16.A、B两元素形成离子化合物时,一个A原子要失去1个电子转移给B原子,而一个B原子要得到2个A原子的电子.下列有关说法正确的是( )
| A. | 它们形成的离子化合物化学式为AB2 | |
| B. | 原子序数:A一定大于B | |
| C. | A和B形成的离子电子层结构一定相同 | |
| D. | A一定是金属,B一定是非金属 |
6.NA代表阿伏加德罗常数值.下列叙述正确的是( )
| A. | 37g丙酸中存在的羧基数目为NA | |
| B. | 1L0.1mol•L-1H2SO3溶液中HSO3-和SO32-离子数之和为0.1NA | |
| C. | 0.5molK在空气中燃烧生成多种氧化物,充分燃烧时转移电子数为NA | |
| D. | 在标准状况下,11.2L乙烷分子所含质子数为9NA |
13.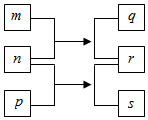 W、X、Y、Z是原子序数依次增大的短周期元素.m、n、p是由这些元素组成的二元化合物,r是元素Y的常见单质,能使带火星的木条复燃,q的水溶液呈碱性,0.01mol•L-1s溶液的pH为12,q、s的焰色反应均呈黄色.上述物质的转化关系如图所示.下列说法正确的是( )
W、X、Y、Z是原子序数依次增大的短周期元素.m、n、p是由这些元素组成的二元化合物,r是元素Y的常见单质,能使带火星的木条复燃,q的水溶液呈碱性,0.01mol•L-1s溶液的pH为12,q、s的焰色反应均呈黄色.上述物质的转化关系如图所示.下列说法正确的是( )
 W、X、Y、Z是原子序数依次增大的短周期元素.m、n、p是由这些元素组成的二元化合物,r是元素Y的常见单质,能使带火星的木条复燃,q的水溶液呈碱性,0.01mol•L-1s溶液的pH为12,q、s的焰色反应均呈黄色.上述物质的转化关系如图所示.下列说法正确的是( )
W、X、Y、Z是原子序数依次增大的短周期元素.m、n、p是由这些元素组成的二元化合物,r是元素Y的常见单质,能使带火星的木条复燃,q的水溶液呈碱性,0.01mol•L-1s溶液的pH为12,q、s的焰色反应均呈黄色.上述物质的转化关系如图所示.下列说法正确的是( )| A. | 原子半径:W<X<Y<Z | |
| B. | Y的氢化物的沸点比Z的氢化物的沸点高 | |
| C. | 通常状况下,X的氢化物可能呈气态、液态或固态 | |
| D. | 由W、X、Y、Z四种元素只能组成一种化合物 |