题目内容
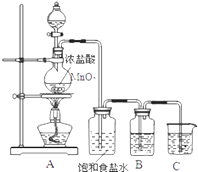
【题目】危化仓库中往往存有钠、钾、硫、白磷(P4)、硝酸铵和氰化钾(KCN)等危险品。请回答下列问题:
(1)NH4NO3为爆炸物,在某温度下按下式进行分解:5NH4NO3=4N2↑+2HNO3+9H2O则被氧化和被还原的氮元素质量之比为________;
(2)硫酸铜溶液是白磷引起中毒的一种解毒剂:1lP4+60CuSO4+96H2O=20Cu3P+24H3PO4+60H2SO4。若8molH3PO4生成,则被CuSO4氧化的P4的物质的量为______________mol;
(3)处理CN一常用的一种方法是用氯气氧化。若某厂废水中含KCN,其浓度为650mg / L。现用氯氧化法处理,发生如下反应(其中N均为-3价):KCN+2KOH+Cl2 = KOCN+2KCl+H2O 。若投入过量液氯,可将氰酸盐进一步氧化为无毒的N2和CO2。请写出该反应的化学方程式,____,若处理上述废水20 L,使KCN完全转化为无毒物质,至少需液氯_________ g。
【答案】 5:3 1 2KOCN+4KOH+3Cl2═2CO2+N2+6KCl+2H2O 35.5
【解析】(1)、5NH4NO3=4N2↑+2HNO3+9H2O的反应中,氮元素由铵根中3价升高为0价,被氧化;氮元素由硝酸根中+5价降低为0价,被还原,根据得失电子守恒可知被氧化的氮原子与被还原的氮原子物质的量之比为(50):[0(3)]=5:3,则被氧化和被还原的氮元素质量之比为5:3,故答案是:5:3。
(2)、Cu元素的化合价由+2价降低到+1价,CuSO4是氧化剂,P4中部分磷元素由0价降低到3价,部分磷元素由0价升高到+5价,磷元素的化合价既升高又降低,所以P4既是氧化剂又是还原剂,若有8molH3PO4生成,则参加反应CuSO4为8mol×![]() =20mol,根据得失电子守恒,则被CuSO4氧化的P4的物质的量为
=20mol,根据得失电子守恒,则被CuSO4氧化的P4的物质的量为![]() =1mol,故答案为:1。
=1mol,故答案为:1。
(3)、反应中KOCN→N2,N元素化合价由-3价升高为0价,共升高6价,Cl2→KCl,Cl元素化合价由0价降低为-1价,共降低2价,化合价升降最小公倍数为6,故N2系数为1,Cl2系数为3,结合原子守恒配平其它物质的系数,配平后方程式为:2KOCN+4KOH+3Cl2═2CO2+N2+6KCl+2H2O;
废水中KCN的质量为650mg/L×20L=13000mg=13g,物质的量为![]() =0.2mol,使KCN完全转化为无毒物质,应生成CO2、N2,整个过程中C元素化合价由+2价升高为+4价,N元素化合价由-3价升高为0价,Cl元素化合价由0价降低为-1价,根据得失电子守恒可知2×n(Cl2)=0.2mol×(4-2)+0.2mol×[0-(-3)],解得n(Cl2)=0.5mol,故需要氯气的质量为0.5mol×71g/mol=35.5g,故答案为:35.5。
=0.2mol,使KCN完全转化为无毒物质,应生成CO2、N2,整个过程中C元素化合价由+2价升高为+4价,N元素化合价由-3价升高为0价,Cl元素化合价由0价降低为-1价,根据得失电子守恒可知2×n(Cl2)=0.2mol×(4-2)+0.2mol×[0-(-3)],解得n(Cl2)=0.5mol,故需要氯气的质量为0.5mol×71g/mol=35.5g,故答案为:35.5。

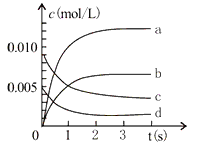
【题目】在2L密闭容器内,800℃时反应:2NO(g)+O2(g) ![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.01. | 0.008 | 0.007 | 0.007 | 0.007 |
(1)已知:K300℃>K350℃,写出该反应的平衡常数表达式:K=_________________。关于该反应的下列说法中,正确的是________。
A.△H>0,△S>0 B.△H>0,△S<0
C.△H<0,△S<0 D.△H<0,△S>0
(2)下图中表示NO2的变化的曲线是____________________。用O2表示从0-2s内该反应的平均速率v=_______________。
(3)能说明该反应已达到平衡状态的是__________。
A.v(NO2)=2v(O2) B.容器内压强保持不变
C.v逆(NO)=2v正 (O2) D.容器内密度保持不变
(4)下列措施中能使n(NO2)/n(NO)增大的有____。(填字母)
A.升高温度 B.加入催化剂
C.不断充入O2 D.充入He(g),使体系总压强增大