题目内容
8.最近材料科学家研究发现了首例带结晶水的晶体在 5K 下呈现超导性. 据报道,该晶体的化学式为Na0.35CoO2•1.3H2O(晶体的摩尔质量为 122g•mol-1). 若用 NA 表示阿伏加德罗常数,试计算 12.2g 该晶体中含氧原子数0.33NA,氢原子的物质的量0.26mol.分析 根据n=$\frac{m}{M}$计算12.2g晶体的物质的量,结合化学式计算含有氧原子、H原子物质的量,再根据N=nNA计算氧原子数目.
解答 解:12.2g晶体的物质的量为$\frac{12.2g}{122g/mol}$=0.1mol,结合化学式可知含有氧原子为0.1mol×3.3×NAmol-1=0.33NA,含有氢原子物质的量为0.1mol×2.6=0.26mol,
故答案为:0.33NA;0.26.
点评 本题考查阿伏伽德罗定律及物质的量有关计算,难度不大,旨在考查学生对基础知识的理解掌握.

练习册系列答案
相关题目
18.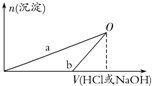 某同学研究铝及其化合物的性质时设计了如下两个实验方案.
某同学研究铝及其化合物的性质时设计了如下两个实验方案.
方案①:2.7g Al$\stackrel{100mLHCl}{→}$ X溶液$\stackrel{NaOH}{→}$Al(OH)3沉淀
方案②:2.7g Al$\stackrel{100mLNaOH}{→}$Y溶液$\stackrel{HCl}{→}$Al(OH)3沉淀
NaOH和HCl的浓度均是3mol/L,如图是向X溶液和Y溶液中分别加入NaOH和HCl时产生沉淀的物质的量与加入盐酸和氢氧化钠溶液体积之间的关系,下列说法不正确的是( )
 某同学研究铝及其化合物的性质时设计了如下两个实验方案.
某同学研究铝及其化合物的性质时设计了如下两个实验方案.方案①:2.7g Al$\stackrel{100mLHCl}{→}$ X溶液$\stackrel{NaOH}{→}$Al(OH)3沉淀
方案②:2.7g Al$\stackrel{100mLNaOH}{→}$Y溶液$\stackrel{HCl}{→}$Al(OH)3沉淀
NaOH和HCl的浓度均是3mol/L,如图是向X溶液和Y溶液中分别加入NaOH和HCl时产生沉淀的物质的量与加入盐酸和氢氧化钠溶液体积之间的关系,下列说法不正确的是( )
| A. | b曲线表示的是向X溶液中加入NaOH溶液 | |
| B. | 在O点时两方案中所得溶液浓度相等 | |
| C. | 方案②中对应的O点HCl恰好反应完 | |
| D. | X溶液显酸性,Y溶液显碱性 |
19.将质量分数为2w,物质的量浓度为c1的乙醇溶液加水稀释,使质量分数变为w,物质的量浓度变为c2,则c1和c2之间关系正确的是( )
| A. | c1>2c2 | B. | c2=2c1 | C. | c2<c1<2c2 | D. | c1=2c2 |
3.LiOH是制备锂离子电池的材料,可由电解法制备.工业上利用如图装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液.下列说法正确的是( )

| A. | B极区电解液为LiCl溶液 | |
| B. | 电极每产生22.4L气体,电路中转移2mole- | |
| C. | 电解过程中Li+迁移入B电极区、OH-迁移入A电极区 | |
| D. | 电解池中总反应方程式为:2LiCl+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2LiOH |
 、
、 .
.