题目内容
12.有A、B、C、D四种短周期元素,原子序数依次增大,A和B原子有相同的电子层数,且A的L层电子数是K层电子数的两倍,C燃烧时呈现黄色火焰,C的单质在高温下与B的单质充分反应,可以得到与D单质颜色相同的淡黄色固态化合物,试回答:(1)元素名称:A碳 C钠 D硫
(2)写出B元素在周期表中的位置,第二周期,第VIA族.
(3)AB2 的电子式为
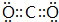 ;C 单质在高温下与B单质充分反应所得化合物的电子式为
;C 单质在高温下与B单质充分反应所得化合物的电子式为 .
.(4)用电子式表示化合物 C2D 的形成过程
 .
.(5)一般情况下,B元素与氢元素形成的化合物是以极性键(填极性或非极性)结合的化合物.
分析 有A、B、C、D四种短周期元素,原子序数依次增大.A和B原子有相同的电子层数,则A、B处于同一周期,且A的L层电子数是K层电子数的两倍,则A有2个电子层,L层电子数为4,故A为碳元素;C单质燃烧时呈现黄色火焰,则C为钠元素;C的单质在高温下与B的单质充分反应,可以得到与D单质颜色相同的淡黄色固态化合物,则B为氧元素,D为硫元素,据此解答.
解答 解:有A、B、C、D四种短周期元素,原子序数依次增大.A和B原子有相同的电子层数,则A、B处于同一周期,且A的L层电子数是K层电子数的两倍,则A有2个电子层,L层电子数为4,故A为碳元素;C单质燃烧时呈现黄色火焰,则C为钠元素;C的单质在高温下与B的单质充分反应,可以得到与D单质颜色相同的淡黄色固态化合物,则B为氧元素,D为硫元素.
(1)通过以上分析知,A是碳,C是钠,D是硫,故答案为:碳;钠;硫;
(2)B为氧元素,处于周期表中第二周期VIA族,故答案为:二;VIA;
(3)CO2分子中碳原子与氧原子形成2对共用电子对,电子式为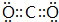 ,C 单质在高温下与B单质充分反应所得化合物为Na2O2,电子式为
,C 单质在高温下与B单质充分反应所得化合物为Na2O2,电子式为 ,
,
故答案为: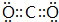 ;
; ;
;
(4)C2D是硫化钠,由钠离子与硫离子构成,硫化钠电子式为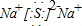 ,用电子式表示其形成过程为:
,用电子式表示其形成过程为: ,
,
故答案为: ;
;
(5)一般情况下,碳元素与氢元素形成的化合物是以极性键结合的化合物,
故答案为:极性.
点评 本题考查结构性质位置关系应用,侧重对电子式的考查,注意掌握电子式表示化学键或物质的性质过程.

练习册系列答案
相关题目
3.下列物质中,属于强碱的是( )
| A. | NaOH | B. | Al(OH)3 | C. | CaO | D. | NH3•H2O |
20.锂被誉为“金属味精”,以LiCoO2为正极材料的锂离子电池已被广泛用作便携式电源.工业上常以β-锂辉矿(主要成分为LiAlSi2O6,还含有FeO、MgO、CaO等杂质)为原料来制取金属锂.其中一种工艺流程如图:

已知:①部分金属氢氧化物开始沉淀和完全沉淀时的pH:
②Li2CO3在不同温度下的溶解度如表:
请回答下列问题:
(1)用氧化物形式表示LiAlSi2O6的组成:Li2O•Al2O3•4SiO2.
(2)反应Ⅱ加入碳酸钙的作用是除去反应Ⅰ中过量的H2SO4;控制pH,使Fe3+、Al3+完全沉淀.
(3)写出反应Ⅲ中生成沉淀A的离子方程式:Mg2++2OH-═Mg(OH)2↓、Ca2++CO32-═CaCO3↓.
(4)反应Ⅳ生成Li2CO3沉淀,写出在实验室中得到Li2CO3沉淀的操作名称过滤,洗涤所得Li2CO3沉淀要使用热水 (选填“热水”或“冷水”),你选择的理由是Li2CO3在较高温度下溶解度小,用热水洗涤可减少Li2CO3的损耗.
(5)电解熔融氯化锂生产锂时,阳极产生的氯气中会混有少量氧气,原因是:加热蒸干LiCl溶液时,LiCl有少量水解生成LiOH,受热分解生成Li2O,电解时产生O2.

已知:①部分金属氢氧化物开始沉淀和完全沉淀时的pH:
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.7 | 9.6 |
| 完全沉淀pH | 3.7 | 4.7 | 11 |
| 温度/℃ | 0 | 10 | 20 | 50 | 75 | 100 |
| Li2CO3的溶解度/g | 1.539 | 1.406 | 1.329 | 1.181 | 0.866 | 0.728 |
(1)用氧化物形式表示LiAlSi2O6的组成:Li2O•Al2O3•4SiO2.
(2)反应Ⅱ加入碳酸钙的作用是除去反应Ⅰ中过量的H2SO4;控制pH,使Fe3+、Al3+完全沉淀.
(3)写出反应Ⅲ中生成沉淀A的离子方程式:Mg2++2OH-═Mg(OH)2↓、Ca2++CO32-═CaCO3↓.
(4)反应Ⅳ生成Li2CO3沉淀,写出在实验室中得到Li2CO3沉淀的操作名称过滤,洗涤所得Li2CO3沉淀要使用热水 (选填“热水”或“冷水”),你选择的理由是Li2CO3在较高温度下溶解度小,用热水洗涤可减少Li2CO3的损耗.
(5)电解熔融氯化锂生产锂时,阳极产生的氯气中会混有少量氧气,原因是:加热蒸干LiCl溶液时,LiCl有少量水解生成LiOH,受热分解生成Li2O,电解时产生O2.
7.下列说法正确的是( )
| A. | 需要加热才能发生的反应一定是吸热反应 | |
| B. | 任何放热反应在常温下一定能发生反应 | |
| C. | 放热反应不需要加热就能发生 | |
| D. | 吸热反应在常温下也能发生 |
2.下列微粒在指定溶液中能够大量共存的一组是( )
| A. | 遇到苯酚显紫色的溶液:SCN-、Na+、SO32-、Cl- | |
| B. | 含有Na2CO3的溶液:Al3+、Ca2+、Cl-、NO3- | |
| C. | 通入足量CO2的溶液:K+、SiO32-、Cl-、NO3- | |
| D. | 25℃时pH<7的溶液:K+、Cu2+、Fe3+、NO3- |




 )
) .由甲苯生成甲的反应类型是取代反应.
.由甲苯生成甲的反应类型是取代反应. +HOCH2CH2Cl$→_{△}^{浓硫酸}$
+HOCH2CH2Cl$→_{△}^{浓硫酸}$ +H2O.
+H2O. .
. .
. .
.