题目内容
12.下列说法正确的是( )| A. | 二氧化硅是酸性氧化物,它可以跟强碱反应,但是不能与任何酸反应 | |
| B. | 根据SiO2+CaCO3$\frac{\underline{\;高温\;}}{\;}$CaSiO3+CO2↑的反应,可推知硅酸酸性比碳酸强 | |
| C. | 二氧化碳气体通入硅酸钠溶液中可以制得硅酸 | |
| D. | 二氧化硅对应的水化物只有H2SiO3 |
分析 A.SiO2是酸性氧化物与碱反应生成盐和水,能与氢氟酸反应生成四氟化硅和水;
B.反应只有在高温条件下进行,由于CO2是气体,逸出反应体系使反应得以继续进行,不能说明硅酸的酸性比碳酸强;
C.向硅酸钠溶液中通入二氧化碳,二氧化碳和硅酸钠反应生成硅酸和碳酸钠;
D.H4SiO4是二氧化硅对应的水化物.
解答 解:A.二氧化硅与氢氧化钠反应生成盐和水,符合酸性氧化物的定义,氢氟酸与二氧化硅发生反应,4HF+SiO2=SiF4↑+2H2O,故A错误;
B.反应只有在高温条件下进行,由于CO2是气体,逸出反应体系使反应得以继续进行,不能说明硅酸的酸性比碳酸强,比较硅酸和碳酸的酸性强弱要比较它们在水溶液中电离出H+的难易程度,故B错误;
C.碳酸酸性大于硅酸,CO2气体通入到Na2SiO3溶液中Na2SiO3+CO2+H2O=Na2CO3+H2SiO3↓,反应生成硅酸沉淀,故C正确;
D.二氧化硅对应的水化物有H2SiO3、H4SiO4等,故D错误.
故选C.
点评 本题考查了硅及其化合物的性质,掌握物质的性质是解答本题的关键,注意根据强酸制弱酸原理,必须在溶液中发生的化学反应,因此B选项,不能得出硅酸的酸性比碳酸强,是易错点,题目难度不大.

练习册系列答案
 导学全程练创优训练系列答案
导学全程练创优训练系列答案
相关题目
3.下列可能大量共存且溶液是无色的离子组是( )
| A. | H+、Na+、NO3-、MnO4- | B. | OH-、Ba2+、Cl-、SO42- | ||
| C. | HCO3-、K+、OH-、NO3- | D. | NO3-、SO42-、K+、Mg2+ |
20.将0.51 mol铜与250 mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2 L.待产生的气体全部释放后,向溶液中加入300 mL 5 mol/L的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀.则下列选项正确的是( )
| A. | 反应中转移电子1.0mol | B. | 产生NO2气体0.26mol | ||
| C. | 原HNO3浓度为8.0mol/L | D. | 原HNO3浓度为6.0mol/L |
7.下列反应所得溶液中一定只含一种溶质的是( )
| A. | 向铁粉中加入一定量的稀硝酸 | |
| B. | 向MgSO4,H2SO4的混合液中滴入过量Ba(OH)2溶液 | |
| C. | 向NaOH溶液中通入一定量CO2气体 | |
| D. | 将物质的量浓度之比为2:7的AlCl3和NaOH溶液等体积混合 |
4.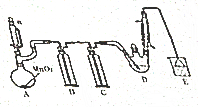 某探究小组设计如图所示装置(夹持、加热仪器略)、模拟工业生产进行制备氯乙醛(CCl3CHO)的实验,查阅资料,有关信息如图所示:
某探究小组设计如图所示装置(夹持、加热仪器略)、模拟工业生产进行制备氯乙醛(CCl3CHO)的实验,查阅资料,有关信息如图所示:
①制备反应原理:C2H5OH+4Cl2→CCl4CHO+5HCl
可能发生副反应:C2H5OH+HCl→C2H5Cl+H2O
CCl3CHO+HClO→CCl3COOH(三氯乙酸)+HCl
②相关物质的部分物理性质:
(1)仪器A中发生反应的化学方程式是MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,装置B中的试剂是饱和食盐水
(2)若撤去装置C,可能导致装置D中副产物CCl3COOH、C2H5Cl(填化学式)的量增加;装置D可采用水浴加热的方法以控制反应温度在70℃左右.
(3)反应结束后,有人提出先将D中的混合物冷却到室温,再用过滤的方法分离出CCl3COOH.你认为此方案是否可行,为什么?不可行,CCl3COOH溶于乙醇与CCl3CHO
(4)装置E中可能发生的无机反应的离子方程式有Cl2+2OH-=Cl-+ClO-+H2O、H++OH-=H2O.
 某探究小组设计如图所示装置(夹持、加热仪器略)、模拟工业生产进行制备氯乙醛(CCl3CHO)的实验,查阅资料,有关信息如图所示:
某探究小组设计如图所示装置(夹持、加热仪器略)、模拟工业生产进行制备氯乙醛(CCl3CHO)的实验,查阅资料,有关信息如图所示:①制备反应原理:C2H5OH+4Cl2→CCl4CHO+5HCl
可能发生副反应:C2H5OH+HCl→C2H5Cl+H2O
CCl3CHO+HClO→CCl3COOH(三氯乙酸)+HCl
②相关物质的部分物理性质:
| C2H5OH | CCl3CHO | CCl3COOH | C2H5Cl | |
| 熔点/℃ | -114.1 | -57.5 | 58 | -138.7 |
| 沸点/℃ | 78.3 | 97.8 | 198 | 12.3 |
| 溶解性 | 与水互溶 | 可溶于水、乙醇 | 可溶于水、乙醇 | 微溶于水、可溶于乙醇 |
(2)若撤去装置C,可能导致装置D中副产物CCl3COOH、C2H5Cl(填化学式)的量增加;装置D可采用水浴加热的方法以控制反应温度在70℃左右.
(3)反应结束后,有人提出先将D中的混合物冷却到室温,再用过滤的方法分离出CCl3COOH.你认为此方案是否可行,为什么?不可行,CCl3COOH溶于乙醇与CCl3CHO
(4)装置E中可能发生的无机反应的离子方程式有Cl2+2OH-=Cl-+ClO-+H2O、H++OH-=H2O.
14.下列污水处理过程,不涉及化学变化的是( )
| A. | 加入明矾净水 | B. | 过滤水中的不溶物 | ||
| C. | 调节水的pH | D. | 沉淀水中的Cu2+离子 |
15.废弃物的综合利用既有利于节约资源,又有利于保护环境.工业上利用铅浮渣(主要成分是PbO、Pb还古有少量的Ag、CaO)可制备硫酸铅.制备流程图如下:
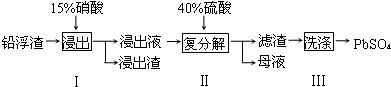
下表是25℃时某些盐的浓度积常数:
(1)实验室用75%的硝酸来配制15%的硝酸溶液,不需用到的玻璃仪器有CD(填标号).
A.烧杯 B.量筒 C.容量瓶 D.锥形瓶 E.玻璃棒
(2)步骤I有NO产生,浸出液中含量最多的金属阳离子为 Pb2+,写出Pb参加反应的化学方程式
3Pb+8HNO3=3Pb(NO3)2+2NO↑+4H2O,为防止Ag被溶解进入溶液,步骤I操作时应注意控制硝酸的用量并使Pb稍有剩余.
(3)母液可循环利用于步骤I,其溶质主要是HNO3(填一种物质化学式),若母液中残留的 SO42-过多,循环利用时可能出现的问题是浸出时部分Pb2+生成PbSO4随浸出渣排出,降低PbSO4的产率.
(4)粗PbSO4 产品含有的杂质是硫酸钙,需用Pb(NO3)2溶液多次洗涤,以得到纯净的PbSO4.
(5)铅蓄电池放电时正极的电极反应式为PbO2+2e-+4H++SO42-=PbSO4+2H2O.如果用铅蓄电池做电源电解饱和食盐水制取Cl2,已知某铅蓄电池中硫酸溶液的体积为0.80L,电解前硫酸涪液浓度为4.50mol•L-1,当制得4.48LCl2时(在标准状况下),求理论上电解后电池中硫酸溶液的浓度为(假设电解前后硫酸溶液的体积不变)4 mol•L-1.

下表是25℃时某些盐的浓度积常数:
| 化学式 | CaSO4 | Ag2SO4 | PbSO4 |
| Ksp | 4.9×10-5 | 1.2×10-5 | 1.6×10-8 |
A.烧杯 B.量筒 C.容量瓶 D.锥形瓶 E.玻璃棒
(2)步骤I有NO产生,浸出液中含量最多的金属阳离子为 Pb2+,写出Pb参加反应的化学方程式
3Pb+8HNO3=3Pb(NO3)2+2NO↑+4H2O,为防止Ag被溶解进入溶液,步骤I操作时应注意控制硝酸的用量并使Pb稍有剩余.
(3)母液可循环利用于步骤I,其溶质主要是HNO3(填一种物质化学式),若母液中残留的 SO42-过多,循环利用时可能出现的问题是浸出时部分Pb2+生成PbSO4随浸出渣排出,降低PbSO4的产率.
(4)粗PbSO4 产品含有的杂质是硫酸钙,需用Pb(NO3)2溶液多次洗涤,以得到纯净的PbSO4.
(5)铅蓄电池放电时正极的电极反应式为PbO2+2e-+4H++SO42-=PbSO4+2H2O.如果用铅蓄电池做电源电解饱和食盐水制取Cl2,已知某铅蓄电池中硫酸溶液的体积为0.80L,电解前硫酸涪液浓度为4.50mol•L-1,当制得4.48LCl2时(在标准状况下),求理论上电解后电池中硫酸溶液的浓度为(假设电解前后硫酸溶液的体积不变)4 mol•L-1.
 某化学研究性学习小组探究Fe3+和SO32-之间发生的反应.
某化学研究性学习小组探究Fe3+和SO32-之间发生的反应.