题目内容
(2009?南充模拟)将5.4g Al投入200.0mL 2.0mol?L-1的某溶液中有氢气产生,充分反应后有金属剩余.该溶液可能为( )
分析:200.0mL 2.0mol?L-1的某溶液中溶质的物质的量为0.2L×2.0mol?L-1=0.4mol,Al的物质的量为
=0.2mol,利用反应判断金属过量,并生成氢气即可.
| 5.4g |
| 27g/mol |
解答:解:200.0mL 2.0mol?L-1的某溶液中溶质的物质的量为0.2L×2.0mol?L-1=0.4mol,Al的物质的量为
=0.2mol,
A、因Al与HNO3溶液不生成氢气,则不符合题意,故A错误;
B、由2Al+2OH-+2H2O═2AlO2-+3H2↑,0.2molAl与0.4molBa(OH)2溶液反应时,碱过量,故B错误;
C、由2Al+6H+═2Al3++3H2↑,0.2molAl与0.4molH2SO4溶液,硫酸过量,故C错误;
D、由2Al+6H+═2Al3++3H2↑,0.2molAl与0.4molHCl溶液,Al过量,故D正确;
故选D.
| 5.4g |
| 27g/mol |
A、因Al与HNO3溶液不生成氢气,则不符合题意,故A错误;
B、由2Al+2OH-+2H2O═2AlO2-+3H2↑,0.2molAl与0.4molBa(OH)2溶液反应时,碱过量,故B错误;
C、由2Al+6H+═2Al3++3H2↑,0.2molAl与0.4molH2SO4溶液,硫酸过量,故C错误;
D、由2Al+6H+═2Al3++3H2↑,0.2molAl与0.4molHCl溶液,Al过量,故D正确;
故选D.
点评:本题考查铝的化学性质,明确铝与酸碱发生的化学反应是解答的关键,并注意利用量来判断过量问题即可解答.

练习册系列答案
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案
相关题目
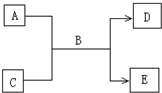 (2009?南充模拟)A、B、C、D、E均为中学化学常见的纯净物,B为自然界中含量最多的液体,它们之间有如下的反应关系:
(2009?南充模拟)A、B、C、D、E均为中学化学常见的纯净物,B为自然界中含量最多的液体,它们之间有如下的反应关系: