题目内容
(1)氨(NH3)是重要的含氮化合物.1774年该气体由英国普里斯特里制得.为了在实验室制取干燥的氨气,甲、乙、丙三位同学分别设计了如下三套实验装置.
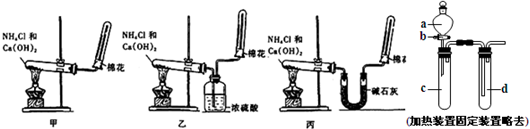
①实验装置和所用药品都正确的是(填“甲”、“乙”或“丙”)
②写出实验室制取氨气的化学方程式
(2)一组同学设计出右图所示装置来进行“铁与浓硫酸反应”实验,以探究化学实验的绿色化.
①实验前,关闭活塞b,试管d中加水至浸没长导管口,塞紧试管c和d的胶塞,加热c.其目的是
②在d中加适量NaOH溶液,向c中放入过量的铁屑和一定量的浓硫酸,塞紧橡皮塞.此时铁屑表面没有气泡生成,说明铁在浓硫酸中发生了

①实验装置和所用药品都正确的是(填“甲”、“乙”或“丙”)
丙
丙
;②写出实验室制取氨气的化学方程式
2NH4Cl+Ca(OH)2
2NH3↑+CaCl2+2H2O
| ||
2NH4Cl+Ca(OH)2
2NH3↑+CaCl2+2H2O
.
| ||
(2)一组同学设计出右图所示装置来进行“铁与浓硫酸反应”实验,以探究化学实验的绿色化.
①实验前,关闭活塞b,试管d中加水至浸没长导管口,塞紧试管c和d的胶塞,加热c.其目的是
检查装置气密性
检查装置气密性
.②在d中加适量NaOH溶液,向c中放入过量的铁屑和一定量的浓硫酸,塞紧橡皮塞.此时铁屑表面没有气泡生成,说明铁在浓硫酸中发生了
钝化
钝化
;给试管c加热,当开始有气泡产生时反应的化学方程式是2Fe+6H2SO4(浓)
Fe2(SO4)3+3SO2↑+6H2O
| ||
2Fe+6H2SO4(浓)
Fe2(SO4)3+3SO2↑+6H2O
,d中反应的离子方程式是
| ||
SO2+2OH-=SO32-+H2O
SO2+2OH-=SO32-+H2O
.分析:(1)实验室用氯化铵和氢氧化钙在加热条件下制备氨气,氨气为碱性气体,应用碱石灰干燥;
(2)①实验前,关闭活塞b,试管d中加水至浸没长导管口,塞紧试管c和d的胶塞,加热c,目的是检查装置的气密性;
②铁与冷的浓硫酸发生钝化作用,可与浓硫酸在加热的条件下发生氧化还原反应生成硫酸铁和二氧化硫气体,二氧化硫有毒,不能直接排放到空气中,应用碱溶液吸收.
(2)①实验前,关闭活塞b,试管d中加水至浸没长导管口,塞紧试管c和d的胶塞,加热c,目的是检查装置的气密性;
②铁与冷的浓硫酸发生钝化作用,可与浓硫酸在加热的条件下发生氧化还原反应生成硫酸铁和二氧化硫气体,二氧化硫有毒,不能直接排放到空气中,应用碱溶液吸收.
解答:解:(1)①实验室用氯化铵和氢氧化钙在加热条件下制备氨气,氨气为碱性气体,应用碱石灰干燥,故答案为:丙;
②氯化铵和氢氧化钙在加热条件下生成氨气,反应的化学方程式为2NH4Cl+Ca(OH)2
2NH3↑+CaCl2+2H2O,
故答案为:2NH4Cl+Ca(OH)2
2NH3↑+CaCl2+2H2O;
(2)①实验前,关闭活塞b,试管d中加水至浸没长导管口,塞紧试管c和d的胶塞,加热c,目的是检查装置的气密性,故答案为:检查装置气密性;
②铁与冷的浓硫酸发生钝化作用,可与浓硫酸在加热的条件下发生氧化还原反应生成硫酸铁和二氧化硫气体,反应的化学方程式为2Fe+6H2SO4(浓)
Fe2(SO4)3+3SO2↑+6H2O,二氧化硫有毒,不能直接排放到空气中,应用碱溶液吸收,反应的离子方程式为SO2+2OH-=SO32-+H2O,
故答案为:钝化; 2Fe+6H2SO4(浓)
Fe2(SO4)3+3SO2↑+6H2O;SO2+2OH-=SO32-+H2O.
②氯化铵和氢氧化钙在加热条件下生成氨气,反应的化学方程式为2NH4Cl+Ca(OH)2
| ||
故答案为:2NH4Cl+Ca(OH)2
| ||
(2)①实验前,关闭活塞b,试管d中加水至浸没长导管口,塞紧试管c和d的胶塞,加热c,目的是检查装置的气密性,故答案为:检查装置气密性;
②铁与冷的浓硫酸发生钝化作用,可与浓硫酸在加热的条件下发生氧化还原反应生成硫酸铁和二氧化硫气体,反应的化学方程式为2Fe+6H2SO4(浓)
| ||
故答案为:钝化; 2Fe+6H2SO4(浓)
| ||
点评:本体考查氨气的实验室制备和铁与浓硫酸反应的性质,题目难度不大,注意常见元素化合物的性质以及化学基本实验操作.

练习册系列答案
相关题目


 (2) 一组同学设计出右图所示装置来进行“铁与浓硫酸反应”实验,以探究化学实验的绿色化。
(2) 一组同学设计出右图所示装置来进行“铁与浓硫酸反应”实验,以探究化学实验的绿色化。